El Centro Argentino de Protonterapia (CeArP) está ubicado en la Ciudad de Buenos Aires. Será el primero en su tipo de América Latina. En julio empieza la instalación del equipo que generará los haces de protones para el tratamiento, que está indicado para tumores de difícil acceso y pacientes pediátricos.
La radioterapia es una de las principales herramientas contra el cáncer. Destruye células malignas, aunque a su paso la energía de la radiación ionizante también afecta a las células sanas. Pero existe una forma más avanzada de radioterapia que minimiza el daño y que muy pronto estará disponible en la Argentina: la protonterapia. La diferencia con la convencional es que los haces de protones pueden dirigirse con precisión milimétrica y recién liberan su energía máxima en el tumor. Después se frenan. Los efectos secundarios sobre los tejidos sanos se reducen y por eso esta técnica está indicada para tratar tumores sólidos de difícil acceso o cáncer pediátrico.
El Centro Argentino de Protonterapia (CeArP) será el primero al sur de los Estados Unidos. Lo están construyendo en avenida Nazca y San Martín, frente al Instituto de Oncología Ángel H. Roffo y junto a la Fundación Centro de Diagnóstico Nuclear. Se trata de un proyecto conjunto entre la Comisión Nacional de Energía Atómica, la Universidad de Buenos Aires y la empresa estatal INVAP, con la colaboración del Hospital de Pediatría Juan P. Garrahan.

El corazón del futuro centro es un ciclotrón modelo C230, del sistema Proteus Plus®, que pesa 230 toneladas. Se trata de un acelerador circular de partículas que produce haces de protones. Esos haces serán conducidos con precisión milimétrica hasta los pacientes a través de dos gantries o portales, que a su vez pesan 110 toneladas cada uno y que se ubicarán en dos salas de tratamiento. También habrá un sector dedicado a investigación y desarrollo, el LAIDEP (Laboratorio de Investigación y Desarrollo en Protonterapia).
Estos equipos fueron adquiridos a la empresa belga IBA (Ion Beam Applications). De acuerdo a INVAP, comenzarán a instalarlos en julio de este año y la tarea requerirá alrededor de 22 meses. Ya se construyó la cámara donde los ubicarán, que tiene paredes de hormigón de hasta 4,5 metros de ancho. El avance de obra de esta parte del edificio es del 77%.

El centro va a contar también con un sector en el que se va a realizar radioterapia con rayos X de altas energías o fotones y que ya tiene un avance de obra del 95%. Para este servicio se adquirió y se está instalando un acelerador lineal Versa HD, que trabaja a velocidades superiores a los equipos convencionales, lo que permite brindar atención a un mayor número de pacientes. También se compró un acelerador lineal para radiocirugía CyberKnife®, que tiene un brazo robótico que se mueve en todas las direcciones e irradia mientras visualiza el tumor a través de imágenes radiográficas en tiempo real.
Además, ya están siendo instalados dos equipos de imágenes, fundamentales para planificar el tratamiento y seguir su evolución: un resonador magnético y un tomógrafo de energía dual.
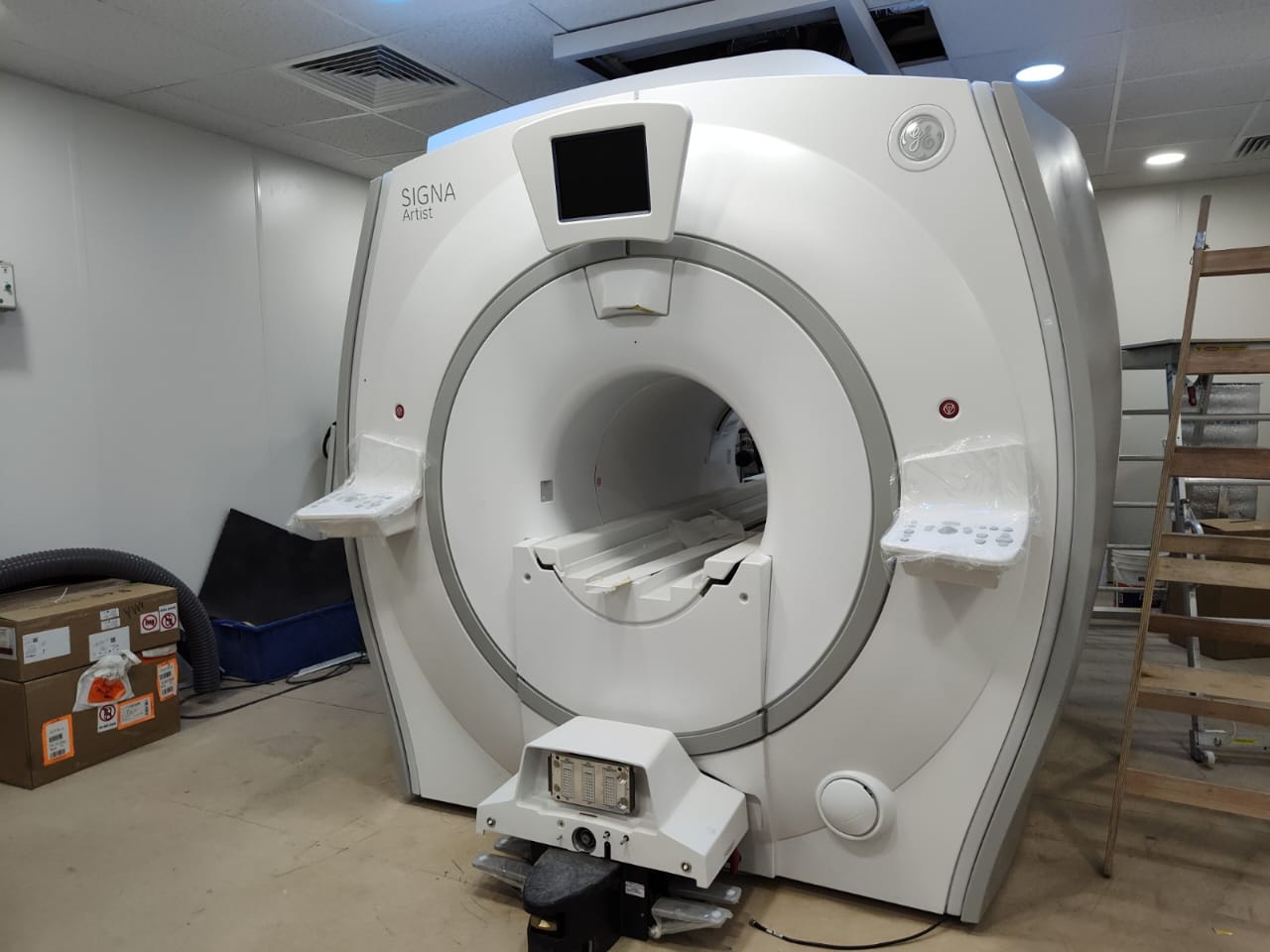
En qué consiste la protonterapia
La protonterapia es un tipo de radioterapia con haces externos de radiación. En la convencional, con fotones, la energía de la radiación ionizante no se frena y va afectando las células del tejido que recorre. “Con la radioterapia de protones, que son partículas subatómicas de carga positiva, se apunta desde diferentes direcciones al blanco tumoral. La curva de energía es invertida, porque al principio es menor y se deposita menos en las estructuras sanas. Después la dosis entregada va en aumento y se produce lo que se conoce como pico de Bragg, al cabo del cual los protones se frenan por completo. Como se puede regular la profundidad donde se alcanza ese pico, se aplica un depósito de energía más alto y mucho más localizado en el tumor a tratar”, explica el físico Gustavo Santa Cruz, gerente del área de Medicina Nuclear y Radioterapia de la CNEA y director técnico y científico del proyecto del CeArP.
“El protón tiene casi 2000 veces más masa que el electrón y rompe estructuras moleculares, como el ADN. Por eso es muy eficiente para destruir las células tumorales”, agrega Santa Cruz.
El ciclotrón puede producir un haz de protones de 230 mega-electrón voltios (MeV) que penetra 32 centímetros en agua. Pero también se lo puede regular, por ejemplo, para que el haz tenga una energía de 70 MeV y se adentre exactamente cuatro centímetros. De esta forma, es posible enviar distintos haces para irradiar el tumor en diferentes puntos, para que reciba la dosis prescrita por el médico con una precisión milimétrica.
Por estas características, la radioterapia con protones tiene menos toxicidad y menos efectos adversos, mejorando así la calidad de vida del paciente. Está indicada para el tratamiento del cáncer pediátrico, tumores del sistema nervioso central, tumores avanzados ubicados en la cabeza o el cuello cuando no son operables o tumores en zonas complicadas como la base del cráneo, entre otros.
Cómo funciona el ciclotrón
El ciclotrón produce el haz de protones a partir de hidrógeno de máxima pureza. Este gas está conformado por núcleos de protones unidos a electrones. Al someter al átomo de hidrógeno a una fuente de ionización, pierde el electrón y queda el protón, que es acelerado en el ciclotrón con un campo eléctrico alterno hasta llegar a dos tercios de la velocidad de la luz.
Después los protones llegan a un degradador, para reducir la energía hasta el valor requerido. Finalmente, se usan un colimador, rendijas y electroimanes para obtener un haz de protones con la energía apropiada. La tasa de dosis en el tumor es de 2 Gy (Grays) por minuto, entregándose fracciones desde 2 Gy hasta 8 Gy según el protocolo, además del tiempo de preparación del paciente para el tratamiento, que suele ser de alrededor de media hora.
El paciente está en una silla robótica que lo mueve para ubicarlo en la posición necesaria. Con los días, a medida que avanza el tratamiento el volumen del tumor se va reduciendo, por lo que cambia el blanco que hay que irradiar y es necesario ajustar la dosimetría.
Gustavo Santa Cruz compara: “Hacer un centro de protonterapia es tan complejo como construir un reactor nuclear. Son instalaciones consideradas Clase 1”. La otra pata de este proyecto es formar un equipo de 12 a 15 personas que serán enviadas a formarse en países como España, Italia y los Estados Unidos, donde existen centros de protonterapia de características similares. En total hay 111 de estos centros en todo el mundo, pero el de Argentina será el primero de Latinoamérica.
Se estima que 120 pacientes por millón de habitantes por año se podrían beneficiar con la protonterapia. Sólo en la Argentina, el número potencial de pacientes candidatos a este tratamiento asciende a 5.200 por año. Cada sala puede tratar como máximo a 300 pacientes por año, así que serían necesarias más de dieciséis para atenderlos a todos. Solamente en Brasil hay 25.000 pacientes por año que se beneficiarían de la protonterapia y a nivel de toda Sudamérica más de 50.000.
Comentario de AgendAR:
Dado el costo tan alto de las instalaciones de protonterapia en todo el mundo, probablemente no logren constituirse en una herramienta de salud pública democratizable al alcance de toda la población. Las colas de acceso serán larguísimas, y la admisión de casos, muy técnica y en términos humanos, muy desgarradora.
Ojo, lo mismo pudo decirse de otros sistemas de medicina radiante cuando eran novísimos, como la gammaterapia o teleterapia en los ’50, y luego el acelerador lineal en los ’80. El modo muy a la Henry Ford de transformarlos en herramientas al alcance de los hospitales públicos fue la fabricación en serie. Todavía se está lejos de eso en protonterapia. INVAP, pese a que construye reactores nucleares, radares y satélites, y hasta ha vendido centros enteros de terapia radiante en Venezuela y Bolivia, en este caso no produce las unidades productoras de haces de iones: los instala en búnkeres.
La CNEA viene peleando desde 2004 en un frente quizás más fácil de popularizar: la terapia por captura de protones en boro, o BNCT, bastante específica para tratamiento de tumores de forma compleja o en ubicaciones complejas. En esas iniciativas también estuvo el físico nuclear Gustavo Santa Cruz. La idea es la misma que con la protonterapia: minimizar la irradiación de tejido sano y destruir con efectividad las células cancerosas.
El problema que viene teniendo históricamente la BNCT es éste: las fuentes de neutrones de potencia relativamente baja necesarias para este enfoque son descomunales por tamaño y costos (mayormente, reactores nucleares). Por ello, los estudios de fase II y III que se pudieron hacer desde principios de siglo involucran a unos pocos centenares de pacientes. Para crear entusiasmo y aceptación internacionales, deberían ser miles.
El Dr. Andrés Kreiner, de la CNEA, vino desarrollando muy contra viento y marea un acelerador de neutrones compatible por tamaño y forma con la arquitectura de un hospital, y libre de complicaciones en materia de licenciamiento nuclear: el sistema no irradia nada cuando está apagado. Despertó inmediatamente interés externo, porque básicamente por problemas de equipamiento, el BNCT es una promesa incumplida desde hace un cuarto de siglo.
A la Argentina en medicina nuclear se la toma muy en serio: INVAP exportó reactores que producen radioisótopos médicos a Perú, Argelia, Egipto, Australia, Arabia Saudita, y ahora está en fase de diseño de uno gigantesco en Holanda. Y mientras tanto, la CNEA y 13 provincias ya inauguraron 14 centros de medicina nuclear.
En 2017, tras exponer en un congreso internacional sobre el acelerador vertical argentino de neutrones, Kreiner fue abordado discretamente a la hora de los canapés y los brindis por las autoridades del KIRAMS, el mayor hospital de oncología de Corea del Sur.
La CNEA vendió entonces la tecnología a Corea por U$ 700.000, pero reteniendo la propiedad intelectual sobre fabricación en serie. Ojalá hubiéramos podido fabricar la primera unidad de escala real, pero corrían malos tiempos para el átomo criollo. Esa historia, aquí y aquí.


