La autorización por parte del organismo se produce dos semanas después de que tanto la Administración de Alimentos y Medicamentos (FDA) de los Estados Unidos como la Agencia Europea de Medicamentos (EMA) registraran la vacuna, en base a estudios clínicos que demuestran su eficacia y seguridad.
La vacuna fue autorizada por ANMAT, al igual que por FDA, para su uso entre las semanas 32 y 36.
“Es muy importante poder considerar este tema en la agenda de Cofesa, con la novedad de la aprobación de nuestra entidad regulatoria, ya que se trata de una herramienta muy importante en el marco del abordaje integral del virus sincicial respiratorio y dada la estacionalidad de la circulación de este virus, la oportunidad de la decisión de los pasos a seguir es clave, explicó Vizzotti, al tiempo que destacó “el rol de ANMAT que hizo el análisis en tiempo real, a la par de las entidades regulatorias de Estados Unidos y Europa, con contacto directo con el laboratorio productor para poder tener en Argentina la posibilidad de avanzar rápidamente en este sentido».
Por su parte, las ministras y ministros de Salud de todo el país celebraron la aprobación de la vacuna por parte de la ANMAT y señalaron la importancia de contar con esta herramienta para prevenir infecciones y hospitalizaciones en menores de un año. Además, subrayaron la ventaja de poder contar con la información de la implementación de la estrategia en el hemisferio norte a partir de las próximas semanas.
“Es una vacuna que hace tantos años se viene esperando en el mundo científico y en los sistemas de salud, que realmente ésta aprobación de la ANMAT cambia significativamente el escenario”, aseguró la ministra de Salud de Córdoba, María Gabriela Barbás, quien consideró positiva la evaluación costo-beneficio ante el impacto que tiene el virus sobre la saturación de los sistemas de salud. “Se trata de una oportunidad única de modificar claramente la historia de la salud publica en lo que se refiere a afecciones respiratorias en pediatría a corto plazo”, añadió.
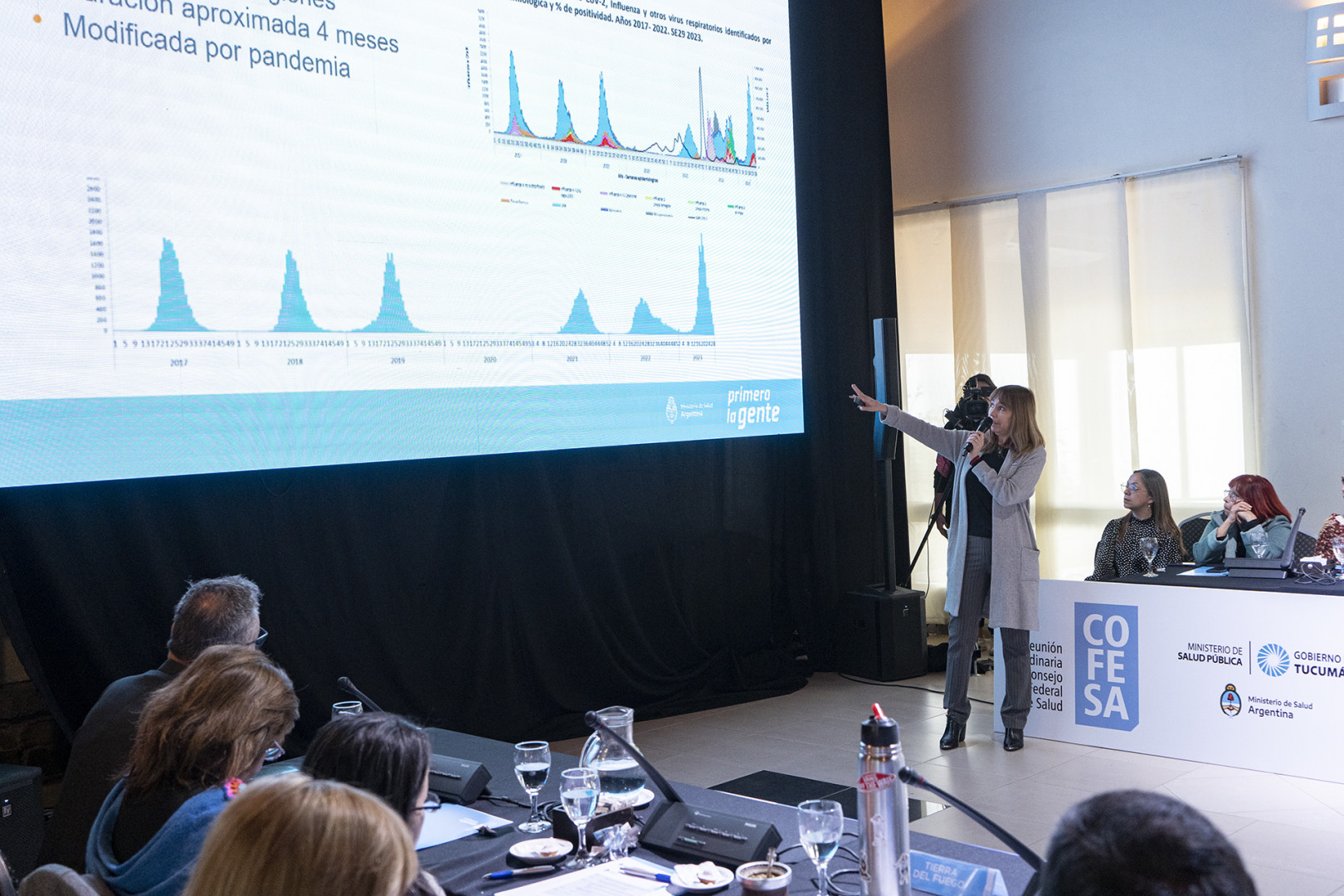
Estudios clínicos
Durante el encuentro, la Secretaria de Acceso a la Salud, Sandra Tirado, presentó a los jefes y jefas de las carteras sanitarias provinciales los resultados de los estudios clínicos de Fase 2 y Fase 3 de la vacuna contra el virus sincicial respiratorio en personas gestantes, una parte de los cuales se realizó en Argentina. Además, se compartió un cuadro de la situación epidemiológica de nuestro país respecto a este virus.
“Se trata de un virus estacional que va variando según las regiones, pero sabemos que cuando surge tenemos cuatro meses de aumentos de casos, de consultas e internaciones”, explicó Tirado, quien agregó que este virus produce la mayor tasa de hospitalización por infecciones respiratorias en menores de 1 año, la mayoría en pacientes sin comorbilidades, además de una sobrecarga y saturación en los servicios pediátricos.
También se informó que la vacuna producida por Pfizer es no adyuvantada y protege contra las variantes RSV-A y RSV-B, con una dosis de 1 mililitro intramuscular que produce una inmunización pasiva a niñas y niños a partir de una vacuna que se aplica a las personas gestantes, produciéndose el pasaje de anticuerpos a los recién nacidos con una fuerte respuesta inmunológica.
Los estudios indican que la eficacia contra enfermedad severa es del 81,8% a los 80 días. Así mismo se observan casos de prematurez tardía sin impacto en la mortalidad ni alcanzando significancia estadística.


