EL WEGOVY REDUCE EL PESO Y EL SÍNDROME METABÓLICO, PERO NO HACE MAGIA, AUNQUE CUESTA COMO SI LA HICIERA
Agradecemos al Dr. Pedro Politi, oncólogo y farmacólogo argentino, por suministrarnos la crítica de Topol que sigue a continuación, y sus explicaciones sobre asuntos regulatorios y de licenciamiento.
LA RESPUESTA DE ERIC TOPOL AL ARTÍCULO DEL NEJM SOBRE WEGOVY
La semana pasada se presentó ante la American Heart Association, con publicación simultánea en el New England Journal of Medicine (NEJM), un gigantesco ensayo de 17.600 pacientes seguidos durante 3 años. En un doble ciego inobjetable, la mitad del grupo recibió aleatoriamente un placebo y la otra el todavía novedoso y muy efectivo reductor de peso Wegovy, de NovoNordisk. Es un bloqueante del receptor del péptido-1, similar al glucagon, llamado semeglútido GLP-1. Peso aparte, aparecieron efectos colaterales beneficiosos para la circulación y el metabolismo.
Esperábamos con impaciencia conocer los resultados reales desde que la empresa patrocinadora (Novo Nordisk) emitió un comunicado de prensa en agosto en el que proclamaba una reducción relativa del 20% de las muertes cardiovasculares, infartos de miocardio o accidentes cerebrovasculares, el principal criterio de valoración del ensayo.
Los participantes en el ensayo presentaban un riesgo muy elevado de sufrir eventos cardiovasculares posteriores, ya que el 68% había sufrido un infarto de miocardio (el 82% padecía una enfermedad arterial coronaria) y el resto había sufrido un ictus o una enfermedad arterial periférica o una combinación de estos criterios de entrada.
Aunque se requería un índice de masa corporal o IMC mayor de 27 kg/estatura al cuadrado para la inscripción, el IMC medio de los inscritos era mayor de 33 kg/estatura al cuadrado; con un 70% de obesos indiscutibles. Había una falta de diversidad etnocultural, con un 84% de blancos y menos de un 4% de negros.
Los participantes no eran diabéticos al inicio del estudio, pero dos tercios tenían una resistencia a la insulina o HbA1c igual o superior al 5,7%, lo que es anormal y suele denominarse prediabetes. La edad media al inicio del estudio era de 62 años (45 años o más era un criterio de admisión). La media de LDL, o colesterol de baja masa, el dañino, en el momento del ingreso era de 78 mg/dl, lo que no es bueno en una población de tan alto riesgo.
El ensayo se estableció para detectar una reducción del 17% en el objetivo primario con una potencia del 90%. Hubo un análisis intermedio en julio de 2022 con 831 eventos que llevó a la continuación del ensayo hasta su final, con un mínimo de 1225 eventos; el ensayo finalizó con 1270 eventos totales que superaban ese objetivo.
Los principales resultados positivos
- El semaglútido redujo en un 20% los acontecimientos graves en esta población de alto riesgo. Ëste es el primer fármaco dirigido a la obesidad que ha logrado este objetivo.
- El seguimiento de 40 meses es el más largo realizado hasta la fecha en un ensayo a gran escala de semaglútido contra placebo, lo que confirma en cierta medida la seguridad de esta duración del tratamiento.
- Hubo una reducción bastante consistente de más o menos el 20% en los diferentes criterios de valoración, aunque el tiempo observado para la divergencia de las curvas de muerte cardiovascular o muerte por cualquier otra causa (gráficos a continuación) se retrasó más de 3 años, en comparación con la separación temprana de las curvas para los criterios de valoración no mortales (principalmente reducción del infarto de miocardio).
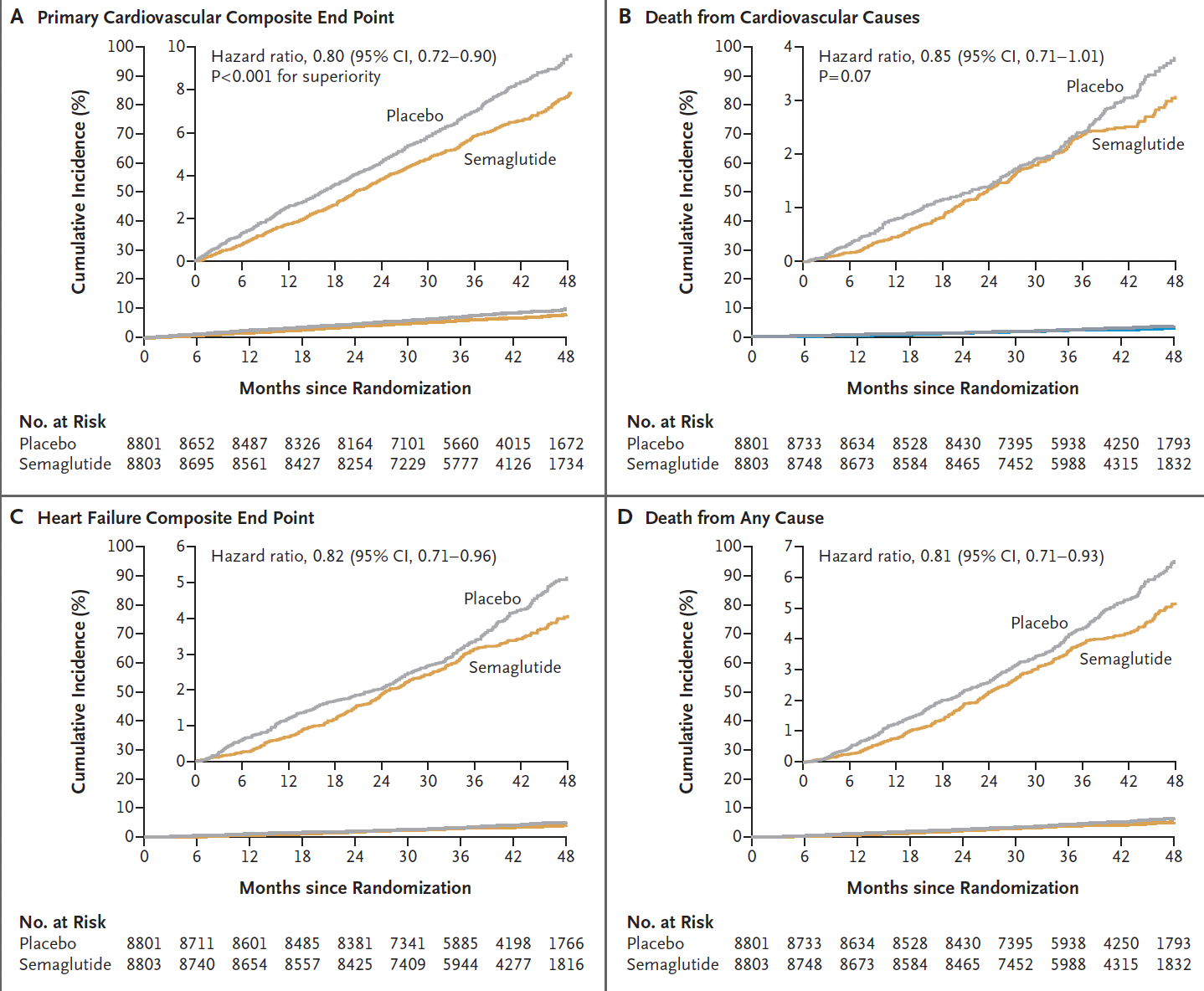
Éste es el análisis del tiempo transcurrido hasta el acontecimiento, que muestra de nuevo la reducción del infarto de miocardio no mortal, mientras que el ictus no mortal no se redujo significativamente (una reducción relativa del 7%). La línea vertical amarilla es la línea de identidad (cociente de riesgos de 1,0); si los intervalos de confianza del 95% la cruzan, ese resultado específico no es estadísticamente significativo.
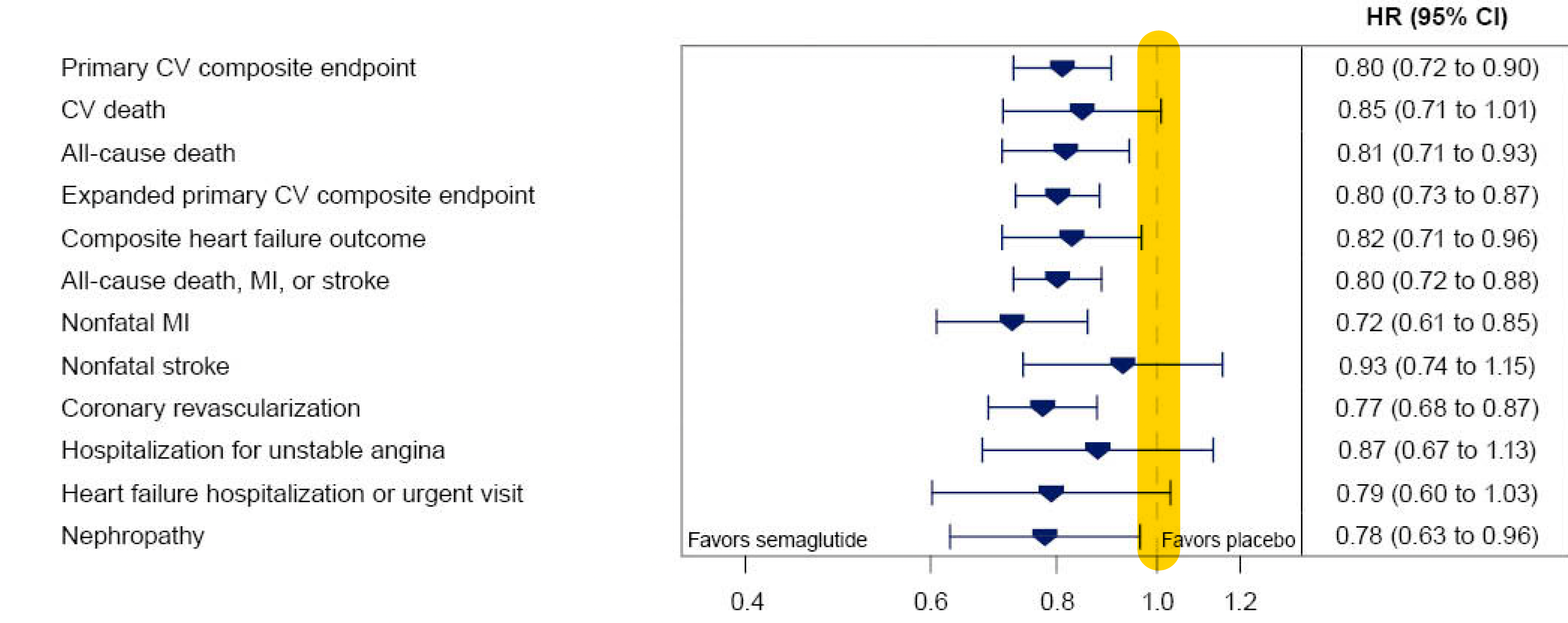
- Como cabía esperar, la reducción de la progresión a diabetes fue sorprendente: sólo el 3,5% progresó a HbA1c > 6,5% en el grupo de semaglutida frente al 12% en el grupo placebo, lo que supone una reducción del 73%. Junto a esto, se produjo una reducción bastante pronunciada del marcador inflamatorio proteína C reactiva, que bajó un 39% frente a un 3%, en el caso del semaglútido contra placebo, respectivamente.
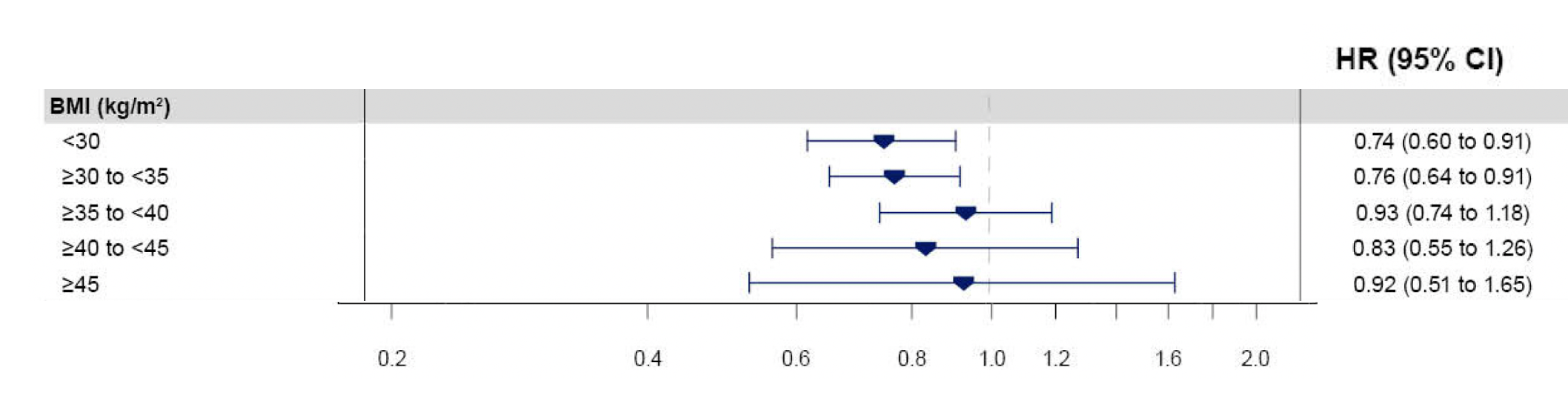
- Los resultados fueron independientes de la categoría de sobrepeso/obesidad al inicio del estudio, como se observa en este análisis de subgrupos para el objetivo primario. De hecho, los subgrupos con menos de 30 y más de 30-35 de índice de masa corporal IMC demostraron la mayor reducción relativa.
Resultados no tan buenos
- La reducción absoluta del criterio de valoración primario es de sólo 1,5 por cada 100 personas tratadas, y las personas del ensayo representan una cohorte de muy alto riesgo. Además, tuvieron que ser tratados durante más de 3 años para obtener ese pequeño beneficio absoluto. Téngase en cuenta que el precio de Wegovy en Estados Unidos es de 1.349 dólares al mes.
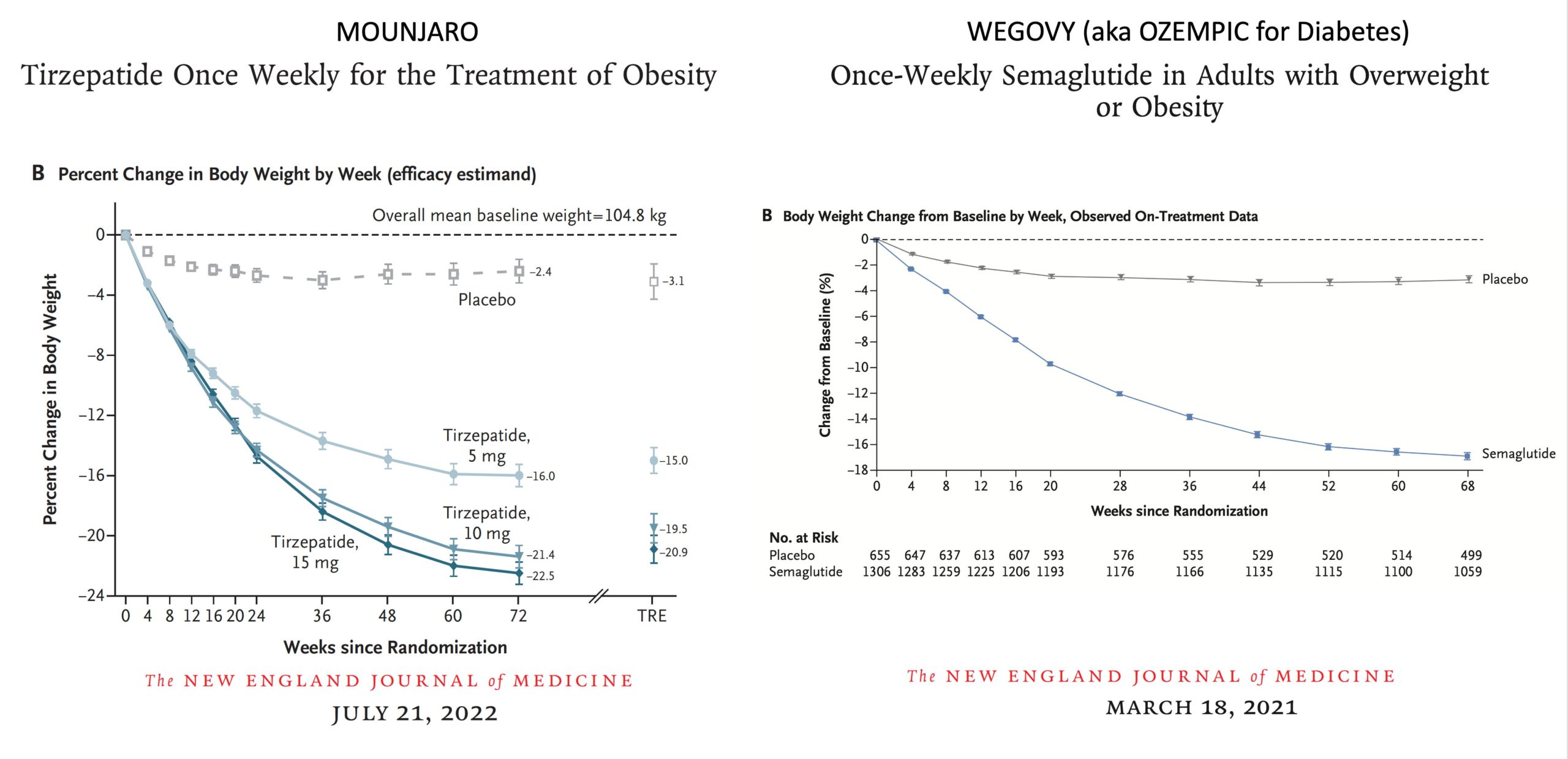
- La pérdida de peso corporal conseguida fue sólo del 8,5%. Como comenté el pasado diciembre, esto es considerablemente menos de lo que se observó en los ensayos aleatorizados anteriores de Wegovy y Mounjaro, más pequeños y con menos tiempo de seguimiento (<1,5 años).
- Queda por ver si una pérdida de peso mayor reduciría aún más los episodios cardiovasculares, y en qué medida la pérdida de peso en sí afectaba a la mejora de los resultados o se debía en parte a otros efectos del fármaco, como la reducción de la inflamación.
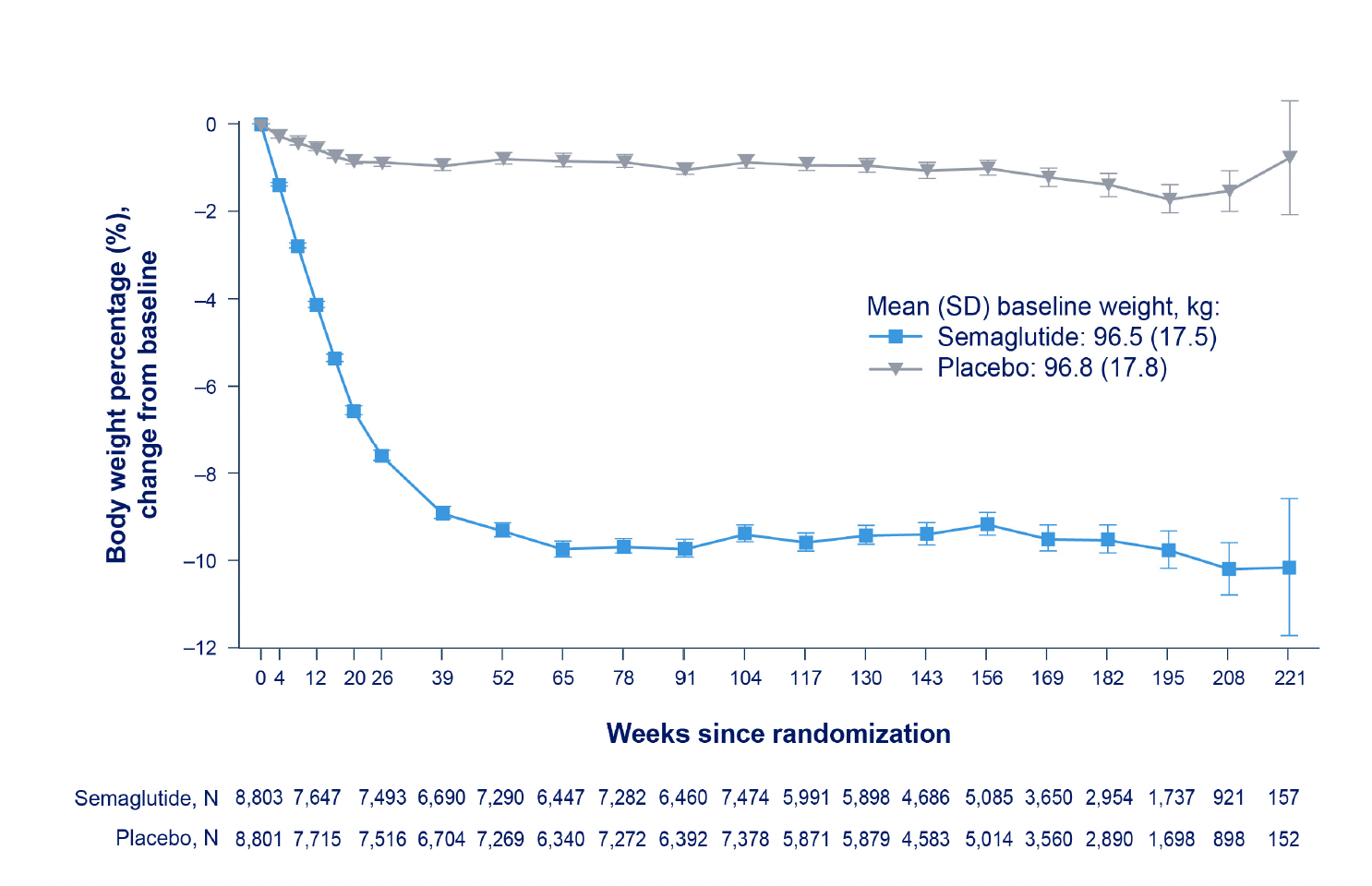
Ensayos aleatorizados previos de GLP-1 para la reducción de la pérdida de peso
- No existe una estrategia de salida. Más allá de la pérdida de peso, sabemos que las personas que toman estos fármacos pierden masa muscular (no medida en el ensayo) y densidad ósea, y las empresas que comercializan estos fármacos no han hecho nada para evaluar las estrategias de retirada y suspensión de los fármacos para evitar estos efectos adversos, sin olvidar otros que pueden aparecer tras una exposición prolongada (varios años).
Resumen
Este ensayo aleatorizado del fármaco GLP-1, bien realizado, es importante para documentar la reducción de los eventos cardiovasculares en una cohorte de alto riesgo. Pero la reducción absoluta (1,5 por cada 100 tratados durante >3 años) es bastante baja, sobre todo teniendo en cuenta el alto riesgo de la población y el elevado coste del fármaco.
Pagar de bolsillo propio el precio completo de 1.349 dólares al mes durante 36 meses equivale a más de 48.500 dólares. Es probable que las aseguradoras, y Medicare, revisen su cobertura basándose en el ensayo para cubrir el fármaco para pacientes de alto riesgo que cumplan los criterios de entrada del ensayo, pero eso representará una carga económica muy grande para cubrir el coste del fármaco.
La aprobación por la FDA de Zepbound (tirzepatide, igual que Mounjaro pero con otro nombre) esta semana, con un coste de 1.060 dólares, parece un poco mejor. Es probable que el acceso a estos fármacos agrave las desigualdades, lo que se suma a la falta de diversidad de las personas evaluadas en el ensayo.
Se necesita mucho más trabajo para resolver la cuestión del beneficio del GLP-1 para las personas obesas pero sin infartos previos o con alto riesgo de eventos cardiovasculares; aún no sabemos nada al respecto. Es posible que los fármacos GLP-1 más potentes y los agonistas de triple receptor consigan un mayor grado de pérdida de peso y amplíen el beneficio a las personas de menor riesgo en el futuro. Todo eso está por ver, y un beneficio absoluto de 1,5 por cada 100 personas tratadas no es nada del otro mundo.
Para mí, la mayor preocupación es que estas empresas parecen estar promoviendo una terapia vitalicia, como es evidente por su nula voluntad de sacar a la gente de los medicamentos sin volver a tomarlos, tanto por el aumento de peso consiguiente como por el riesgo de resultados adversos. Esto es claramente inaceptable y se necesita una mayor presión para que todas las empresas que fabrican este tipo de fármacos prueben y validen estrategias de salida duraderas y seguras.
.ERIC TOPOL