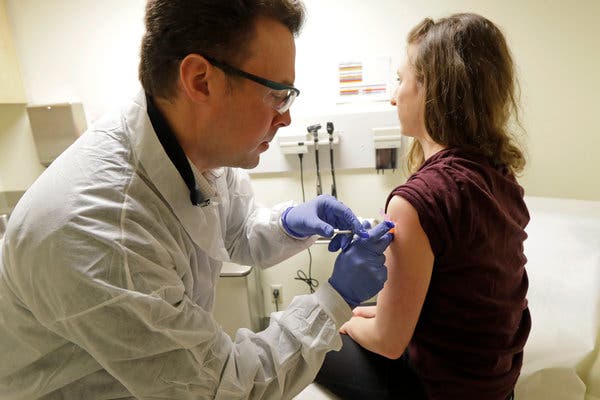
EL NIAID, National Institute of Allergy and Infectous Diseases (Instituto Nacional para las Alergias y Enfermedades Infecciosas de los EEUU) en colaboración con la biotecnológica Moderna Sciences de Cambridge, Massachussets, acaban de empezar la fase 1 del primer intento de una vacuna contra el coronavirus pandémico Covid-19. Se está inyectando la fórmula a 45 adultos voluntarios sanos de entre 18 y 55 años.
Las cosas se hacen bajo el sistema “fast track” (vía rápida) de la agencia federal de licenciamiento farmacológico, la FDA (Food and Drug Administration). En este caso, se obvian las pruebas en ratones u otros modelos animales y se empieza un estudio de toxicidad con humanos llamativamente grande (suelen ser entre 10 y 20).
Por supuesto que se empezará a medir eficacia a en respuesta de anticuerpos ante tres dosis distintas de vacunamiento, pero el objetivo central de una fase 1 es más modesto: mostrar que la vacuna no es tóxica. ¿De qué modo podría serlo? Contiene ARN mensajero del Covid-19, justamente la secuencia que codifica los antígenos que lo recubren, moléculas de forma muy compleja que el virus emplea para anclarse, con un encaje perfecto, tipo llave con cerradura, en las proteínas que tapizan las células de los epitelios respiratorios.
Fue el Dr. Anthony Fauci, jefe del NIAID, quien autorizó a Moderna a proceder con humanos porque la empresa tuvo éxito con una vacuna contra el MERS (Middle East Respiratory Syndrome) o Síndrome Respiratorio de Medio Oriente. Fauci está blindado a toda presión o serruchada de piso por décadas de prestigio como funcionario científico intachable. Es un Elliot Ness de la virología, un intocable capaz de desmentir tranquilamente al presidente Trump en la cara cuando éste, en conferencia de prensa, dice tener dominado al Covid-19 y promete una vacuna en meses. Ninguno de los superiores de Fauci en el tótem del NIH (National Institute of Health) podría jugarse una carta tan brava: ensayar en voluntarios sanos una vacuna con apenas 66 días de desarrollo de laboratorio.
El MERS es otra zoonosis reciente. Lo causa otra especie de coronavirus de los camellos, bastante parecida al Covid-19 por su secuencia genética, y comparado con el Covid-19 es mucho más mortal aunque también más lento para el contagio entre personas. La baquía de Moderna con el MERS le permitió una velocidad impresionante en el diseño y formulación de esta vacuna, esencialmente un trozo de ARN del Covid-19 encapsulado en una vaina de lipoproteínas.
Lo que se busca es que el sistema inmune de cada inyectado sano reaccione contra este antígeno desconocido por los humanos, dado que el Covid-19 también es una zoonosis, causada en este caso por un virus de murciélago que pasó a nuestra especie a fines de 2019.
El sistema inmune humano es muy entrenable: la idea es que ahora identifique un nuevo blanco. El peligro de una sobredosis de vacuna puede ser una reacción inmunológica masiva, lo que se llama una “tormenta de citoquinas”. Es algo que ha sucedido en la fase terminal de algunos de los infectados que murieron: sus células inmunes atacaron el escaso parénquima pulmonar sano que les dejó la sobreinfección con bacterias neumocóccicas, lo que agravó en forma letal su insuficiencia respiratoria, ya aguda.
Si dentro de 3 meses la este prototipo de vacuna no mostró mayor toxicidad pero sí una respuesta interesante de anticuerpos, la FDA (Food and Drug Administration) autorizará a medir la eficacia clínica en otro grupo mucho mayor. Ésta segunda vez el estudio se hará “a doble ciego”, comparando el rendimiento de una rama de receptores inyectados con un “placebo”, o sustancia inocua, y una segunda rama tratada con la vacuna. Ahí estaremos hablando de centenares de pacientes en cada rama.
La expresión “doble ciego” surge de la necesidad de filtrar todo efecto psicológico. La confianza en el medicamento puede aumentar hasta un 20% su eficacia clínica, y falsear su performance bioquímica. Los pacientes no sabrán en qué rama cayeron, y los que dirigen el experimento tampoco hasta promediando el testeo, cuando aparezcan los resultados.
Si en esa fase 2 la fórmula mostrara no sólo distinta respuesta entre ramas medible en producción de anticuerpos, sino fundamentalmente en diferente protección contra el contagio, la FDA, como agente de licenciamiento de fármacos del gobierno de los EEUU, abrirá una fase 3.
Ésta seguramente será multicéntrica, tomará lugar en varios hospitales a la vez, y se hará siempre a doble ciego, con miles de pacientes en cada rama. Si efectivamente la vacuna sirve en forma estadísticamente medible y tiene bajos efectos colaterales, es autorización segura. Pero puede haber intercurrencias, malas y buenas.
Las malas: reacciones inmunológicas descontroladas contra la vacuna. Pueden impedir el progreso a fase 2, o desde ésta a fase 3. Lo mismo puede suceder debido a la poca eficacia.
Intercurrencias buenas: que en medio de la fase 3, los resultados preliminares sean tan favorables en la rama de los vacunados que el Comité de Bioética decida acortar camino. En ese caso mandará a vacunar en serio a todos voluntarios los que recibieron placebo, y la FDA ejecutivamente autorizará a Moderna para la producción, venta y distribución masiva. Normalmente cruzar las tres fases de la FDA con una novedad total toma entre 5 y 10 años, pero la expansión pandémica del Covid-19 ha sido tan explosiva que rige la legislación “fast track”. Como sea, es casi imposible que la vacuna esté lista antes de un año. Y bien puede suceder que termine siendo aprobada antes otra fórmula de alguna firma distinta. Pero el índice NASDAQ apuesta a que no: el lunes 16 las acciones de Moderna subieron un 25% en medio de un derrumbe bursátil como no se lo ve desde 2008.
(Continuará mañana)
Daniel E. Arias