Lectores: están viendo un desarrollo argentino quizás destinado a volverse “de primera línea” en el mundo durante este siglo. Hace 30 años que la radioterapia BNCT (Boron Neutron Capture Therapy), por captura de neutrones en boro, está a punto de revolucionar el tratamiento de los cánceres sólidos más infiltrantes e intratables y de peor localización.
Pero hace 30 años que eso no sucede por falta de “fierros adecuados”: se necesita una fuente de neutrones de baja potencia capaz de funcionar dentro de un hospital. Es el único modo de tratar suficientes pacientes como para completar estudios de fase 1, 2 y 3 y ver si la BNCT se puede volver una terapia estándar, en lugar de una rareza experimental.
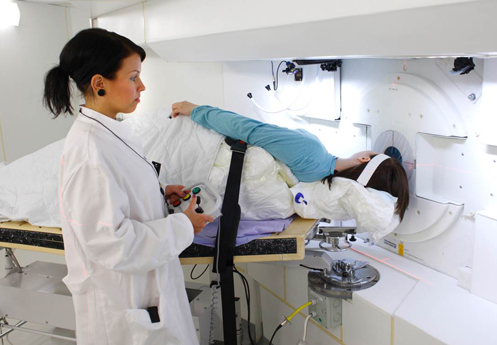
La noticia: los fierros adecuados son argentinos. Son los de la foto que encabeza esta nota. Abajo del cabezal, Suárez Sandín, Igarzábal y Conti, el equipo encargado del montaje mecánico en el KIRAMS, o Korean Institute of Radiotherapy and Medical Sciences. Es la clínica oficial en terapias radiantes de Corea del Sur, está en Seúl y ocupa un edificio monumental, el que se ve abajo.

Cuerpo principal del edificio del KIRAMS, Korean Institute of Radiotherapy and Medical Sciences, donde hoy se está montando el acelerador de neutrones de la CNEA
Mientras no existían aceleradores de neutrones, en varios países del mundo se usaron reactores nucleares como fuente de neutrones terapéuticos en BNCT, pero con resultados frustrantes. Fuimos parte de esa movida: en los ’90 la Dra. Sara Liberman empezó una propuesta de BNCT desde la CNEA, ella sola con su alma al principio, pero fue reclutando renuentes y escépticos iniciales en radiobiología y entre los físicos y químicos de reactores, y con los radioterapistas del Instituto de Oncología Ángel Roffo, dependiente de la Facultad de Medicina de la UBA.
Liberman no trabajó en vano: en 2003, ya de modo oficial, la Comisión Nacional de Energía Atómica (CNEA) y el Instituto de Oncología Ángel Roffo, dependiente de la Facultad de Medicina de la UBA, intentaron ensayos de fase 1 de este tipo de terapia en el reactor nuclear RA-6 del Centro Atómico Bariloche.
Cuando empezaba aquel experimento clínico, publiqué un artículo entusiasta en el suplemento científico que dirigía Nora Bär, en La Nación, muy leído entonces por la comunidad médica. Un oncólogo amigo me advirtió: “Arias, la BNCT va a ser la radioterapia del futuro… siempre. Nunca logran juntar suficientes casos”.
Mi amigo tenía razón, pero por causas equivocadas. El problema eran y son los fierros, no la terapia en sí. El RA-6 es un aparato inmenso y tan inmóvil como el edificio blindado de contención que lo rodea. Los móviles en este caso debían ser los pacientes, 10 residentes del AMBA con melanomas –los cánceres de piel más agresivos- diseminados en piel y órganos.
Aún en fase terminal, los pacientes debían estar lo suficientemente estables como para resistir el traslado. A la Dra. Berta Roth, del Roffo, no le fue fácil armar “un seleccionado”: sólo se trataron 10 pacientes. Es lo típico de una fase 1 destinada no a medir la eficacia del tratamiento, sino únicamente su toxicidad.
Acondicionar el RA-6 para armarle un radioquirófano al pie tampoco fue fácil. El producto básico de un reactor de investigación son los haces de neutrones, esa materia prima invisible pero de alta energía con que uno irradia diversos materiales, a veces para ver qué sucede. En uno de los canales de salida de tales haces se colocaron materiales de frenado de los neutrones, de modo de volverlos “epitérmicos”, es decir de muy baja energía. Los de alta energía no tienen utilidad clínica.
Apilando ladrillos de plomo en torno a esta fuente de neutrones “casi fríos” se improvisó un radioquirófano de quita y pon, donde el paciente podía sentarse para que se le irradiaran exclusivamente las piernas, el sitio preferencial de brote de las metástasis del melanoma.
La base radioquímica de la BNCT es ésta: al paciente se le inyecta una solución nutritiva borada. La de uso en Argentina fue la borofenilalanina, o BPA, un aminoácido de los 20 que componen las proteínas humanas, sólo que “marcado” con un átomo de boro. Dado que las células cancerosas son metabólicamente hiperactivas y están generando proteínas a toda máquina para dividirse, absorben esta solución nutritiva 3,5 veces más que las células sanas.
Un radioquirófano de BNCT estadounidense. La iluminación con neutrones, como se ve, es unidireccional: no necesita de múltiples y sucesivos ángulos de entrada. Y las terapias son breves.
A su vez, cada átomo de boro es unas 1000 veces más propenso a atrapar neutrones epitérmicos que los 4 elementos que forman la arquitectura molecular de cualquier organismo terrícola: carbono, hidrógeno, oxígeno y nitrógeno.
Cuando un neutrón epitérmico es atrapado por un atómo de boro, éste último estalla, bum. Bueno, sin efectos de sonido, pero literalmente hace fisión nuclear: se desintegra con violencia en un ión de litio 7 y un núcleo de helio, partículas eléctricamente cargadas y de gran masa que irrumpen en el núcleo de las células como elefantes en un bazar: rompiendo todo.
Pero justamente por su alta masa y carga eléctrica, estos productos de fisión tienen recorrido cortísimos, se frenan tras atropelladas de apenas entre 5 y 9 micrómetros. Es decir que en general no logran salir del volumen de la célula cancerosa embebida en boro.
Esto hace bien selectiva la radiotoxicidad de la BNCT: las células cancerosas se mueren al toque, con su genoma despedazado, mientras que las sanas contiguas, debido a su escasa captación de boro, son mucho más resistentes a los neutrones.
En la práctica, y por otros fenómenos radiológicos que cambian según el tipo de tumor y su profundidad, esa vulnerabilidad diferencial es variable. En oncología sigue sin existir «la bala mágica» que sólo da en el centro del blanco, pero con nuevos abordajes se puede agrupar mejor los tiros…
En contraste, la masa tumoral puede haber absorbido selectivamente 50 o 60 Gray de radiación, una dosis letal, en apenas un par de sesiones. Y esto le debería alegrar la vida a todo el mundo: las terapias BNCT en principio no duran semanas sino días, el paciente puede tener algo más de vida personal y extraterapéutica, y el acelerador de neutrones puede tratar a más gente en menos tiempo.
Si le parece demasiado perfecto para ser real, tiene razón: el diablo está en los detalles. Por empezar, la circulación sanguínea intratumoral es infernalmente despareja: hay sectores de cada tumor que casi no reciben sangre, y por ende no se embeben de boro, y reniegan de la cortesía de morirse bajo el haz de neutrones.
¿Cómo producir neutrones epitérmicos, ante todo? Es la pregunta del millón, y al parecer aquí finalmente tuvimos la respuesta adecuada. Acelerar cosas con carga eléctrica es bastante simple: un liviano electrón negativo se repele con un campo eléctrico negativo o se atrae con otro positivo. Del mismo modo, un pesado protón positivo se mueve, desvía o frena con campos de signo igual o contrario al suyo, y ése es todo el arte de disparar haces de partículas subatómicas. Pero el neutrón es exactamente lo que dice su nombre: indiferente a la atracción y a la repulsión.
La solución Nac & Pop que inventó Andrés Kreiner involucra 2 veces el uso de un artículo de fabricación nacional: agua pesada, o D20, o dióxido de deuterio (el deuterio es el átomo de hidrógeno con el añadido de un neutrón).
El acelerador de la CNEA disocia el agua pesada en oxígeno y deuterio, le arranca los electrones al deuterio generando “deuterones” de carga positiva, y los dispara con gran energía contra un blanco de berilio o de carbono 13.
Esto provoca el estallido nuclear de los átomos impactados, con gran emisión de neutrones de energía generalmente demasiado alta, medible en un rango de alrededor de un MeV (mega-electrónvolt). Hay que frenarlos brutalmente a una centésima parte de esa potencia, y ahí quedan listos para entrar en el paciente y destruir selectivamente las células que estén embebidas en boro.

El físico nuclear Andrés Kreiner en su laboratorio del Centro Atómico Constituyentes, foto de Pedro Roth, gentileza de TSS
Un truco que puede mejorar la performance de la BNCT con tumores muy profundos y en gente voluminosa es “embeber” al paciente en agua pesada, haciéndole tomar D20 hasta sustituir 1/3 del contenido de agua de su cuerpo. Esta idea, propuesta por investigadores británicos, vuelve al paciente aún más “transparente” a los neutrones epitérmicos, que sólo se frenan del todo al ser absorbidos por los tumores dopados con boro.
Sin usar agua pesada ni acelerador de neutrones, en casi todos los 10 pacientes tratados entre 2003 y 2007 en el reactor RA-6 hubo remisiones sorprendentes en las piernas, lo único irradiado. Pero los tumores desparramados en torso, cabeza y brazos de los enfermos siguieron su trabajo letal. Ninguno de esos está vivo a fecha de hoy.
Va de nuevo: de acuerdo con el “Primum non nocere” (ante todo, no dañar) de Galeno (el médico griego, no la prepaga argentina), lo que se estaba midiendo en el RA-6 era la posible toxicidad de la terapia, es decir si había una disminución de la sobrevida esperable.
No se estaba midiendo un aumento de la sobrevida (no lo hubo), y tampoco una respuesta clínica (que sí la hubo, con remisiones y disminuciones de tamaño notables de las metástasis en la zona irradiada).
¿Suena cruel? No hay modo de que un «trial» de toxicidad parezca bonito. Creo que quienes diseñaron ese protocolo no esperaban ver cambios dramáticos: en tal caso, quizás habrían apostado a riesgos mayores pero también a beneficios mayores, como la irradiación de cuerpo entero. No se debería diseñar un experimento, incluso de toxicidad, en el cual pudiendo haber alguna pequeña mejora para el paciente, se la excluya.
El paso siguiente era intentar la irradiación en otras diez áreas anatómicas, y en otros tumores diseminados: hepático, colorrectal, tiroideo, pulmonar y de cavidad oral.
Todo muy ambicioso, pero no sucedió: intercurrió la diplomacia “con efectos adversos”: la Argentina estaba obligada a cambiarle el combustible al RA-6 por acuerdos con el OIEA (Organismo Internacional de Energía Atómica). Tenía fecha límite para devolver a los EEUU el uranio enriquecido al 90%, “grado bomba”, de su núcleo (antes de los ’90 todos los reactores eran así), y sustituirlo por otro núcleo de enriquecido al 20%, militarmente inofensivo.
Eso obligó al rediseño de toda la planta, asunto que tomó años. Entre tanto, al compás de diversos actos electorales, la dirección política del país, la la CNEA y la de la Universidad de Buenos Aires habían cambiado de titularidad varias veces. Retomar un programa con muchos actores como aquel de 2003 en Argentina normalmente insume el trabajo de retejer alianzas, pasillear, y meta mail y celular hasta volver a alinear todos los patitos…
Llega 2008 y recalculando…
Recién en 2008, con Norma Boero al frente de una CNEA con bastantes ganas de resucitar, y con el físico Gustavo Santa Cruz sumado al equipo se logró juntar 70 a profesionales para implementar la clínica un proyecto BNCT.
Y vista la experiencia pasada, se decidió que un reactor nuclear de investigación en radioterapia es como recargar celulares con un turbogrupo diésel: equipo demasiado potente, demasiado inmóvil, que exige demasiadas adaptaciones y además queda demasiado a trasmano y se usa para otras cosas. Bariloche es Patagonia Norte, y los pacientes del Roffo están a 1580 km., y eso en línea recta y por aire.
Por lo demás, al RA-6 el país lo necesita para formar nuevos ingenieros, físicos, químicos y médicos nucleares, que no nos sobran. Sin esos recursos humanos la Argentina no sería capaz de inventar nada nuevo en radioterapias.
En 2015, el RA-6 inició nuevos ensayos preclínicos (usando animales cancerizados) con algunas mejoras en el haz de irradiación. Pero se venía un cambio de guardia tecnológico: el doctor en física Andrés Kreiner, experto en aceleradores de partículas subatómicas desde 1974 y estudioso de la BNCT desde 1996, recibió luz verde de Norma Boero para construir una fuente de neutrones epitérmicos en el Centro Atómico Constituyentes.
Además del adiós a los reactores, la ventaja geográfica es que si los pacientes deben venir desde el Instituto Roffo, son 5,4 kilómetros por Avenida San Martín hasta la General Paz y Constituyentes. Es media hora de ambulancia y no hay ningún traslado aéreo.
El acelerador de neutrones es el futuro. La escueta flota mundial de reactores está ocupada en sus misiones de diseño: formar RRHH y en los casos de los aparatos de producción, crear radioisótopos médicos. Por ende, es irreal exigirles que además sirvan como radioquirófanos.
Sólo bajar apenas un 1% la producción mundial de radioisótopos médicos costaría más vidas en varios frentes médicos que las que podrían salvarse con BNCT en el frente oncológico. Esto viene frenando a la BNCT como eventual tratamiento estándar desde los ’90. Y lo otro que lo frena es que no cualquiera hace un buen acelerador de neutrones.
Aún así, otros países fueron más audaces y pertinaces y lograron resultados más sorprendentes con BNCT en reactores: por ejemplo, eliminación de melanomas vulvares y peneales, cuyo abordaje con cirugía o con terapias radiantes fotonicas (rayos gamma o equis) habría sido mutilante.
La universidad de Pavia, Italia, llegó al extremo de extirparle el hígado a dos enfermos de hepatoma, transporar esos órganos para una “barrida” con neutrones en el reactor académico LENA, y reimplantarlos hora y media después a los pacientes. 100% de remisión sostenida desde 2013, aunque uno de los pacientes sucumbió poco después a un evento cardíaco no asociado. Es increíble y bastante espectacular, pero 2 casos estadísticamente no significan nada. Y no todo paciente resiste ese tiempo en un quirófano sin su hígado, ni todo quirófano universitario tiene un reactor tan a tiro.
En Japón se hizo un ensayo con pacientes con glioblastoma multiforme, un cáncer cerebral no sólo muy intratable (por infiltrante, genera tentáculos como de medusa) sino muy radioresistente.
Nuevamente, las tasas de sobrevida libre de síntomas de los irradiados excedían lo esperable (12 a 18 meses), pero nuevamente, los casos sumaron algunas decenas y su costo convenció a las obstinadas autoridades médicas japonesas de que llevar un paciente a un reactor era como pretender que la montaña fuera hasta Mahoma.
Japón entonces decidió desarrollar otras fuentes de neutrones, lo que provocó el entusiasmo corporativo de Sumitomo, Mitsubishi e Hitachi por llegar primero y con la mejor. Puede haber cierto resentimiento coreano por no elegir los desarrollos BNCT japoneses. Japón fue un despiadado ocupante imperial de Corea entre 1910 y 1945. Pero sospecho que los muchachos del KIRAMS prefirieron la tecnología argentina porque es bastante más sensata. La de Sumitomo, por ejemplo, empieza con un ciclotrón… y luego se complica aún más.
También, para el caso, los coreanos prefirieron nuestra oferta a la estadounidense. Estamos compitiendo contra 8 países con desarrollos BNCT. Y no estamos perdiendo. Uno de los puntos imbatibles del acelerador de la CNEA es que, una vez apagado, no presenta radioactividad residual pasados los 2 minutos y medio.
Sin embargo, aquí no todo anda tan sobre rieles. En 2016 era obvio que se necesitaba la fuente de neutrones de Kreiner, por ahora incómodamente compactada bajo un techo normal, necesitaba un recinto de al menos a 11 metros de altura para alcanzar su potencia de diseño de uso clínico, como para empezar a testearlo en estudios de fase 1, 2 y 3.
Si ese aparato alcanzara una aprobación regulatoria del ANMAT con buenos resultados, no sólo habría cola de pacientes para usarlo, sino cola de fabricantes para producirlo y exportarlo. Pasaron 5 años y ese búnker todavía no está construido.
¿Falta de plata, o también de perspectiva? Mirando el panorama con fríos ojos capitalistas, las terapias radiantes hoy son empleadas como abordaje principal o como refuerzo de algún otro abordaje en el 50% de los casos de cáncer. Incluso una porción chica de esa torta gigante es mucho mercado.
Los abordajes emergentes favoritos en tumores complicados y diseminados en lugares difíciles son los aceleradores para protonterapia o hadronterapia. Pero son máquinas desesperadamente caras. Un protocolo completo de hadronterapia en EEUU le sale al paciente entre U$ 30.000 y 120.000.
Fieles a la tradición del hogar de los valientes y la tierra de los libres, como se autodescriben en su himno nacional, los estadounidenses enfermos sin seguro médico son libres de no pagar y morirse. Y los que tienen algún seguro médico, libres también de elegir un abogado que ahorque a sus prepagas para que éstas pongan la tarasca, y eso si les alcanza el dinero y su tumor les concede el tiempo.
La paradoja de los costos bestiales es que matan el mercado: las clínicas muy avanzadas en EEUU cierran por falta de pacientes, según se puede ver en este artículo de MedPage Today.
Me explico: el Scripps Health, clínica de San Diego, California, en 2014 anunció, como si fuera un triunfo, la apertura de su centro de protonterapia, que costó U$ 220 millones. El fierro arranca con un ciclotrón superconductivo, el cual genera un plasma de hidrógeno y oxígeno que a su vez emite protones que circulan a 165.000 km/segundo.
Estos haces de protones se derivan a distintos radioquirófanos donde son usados para tratar simultáneamente a varios pacientes con tumores complejos de próstata, cuello y cabeza, mamario, espinal, pulmonar y gastrointestinal. Ah, también se atienden niños.
Hasta ahí, tecnología de la Guerra de las Galaxias. Pero como añade, angelical, el comunicado de prensa, la decoración cálida de las instalaciones, con uso de piedra, madera y teja, colabora con la curación. En EEUU esos materiales de construcción deben estar caros, porque el equipo de protonterapia que está adquiriendo el Instituto Roffo cuesta bastante menos de la mitad que el del Scripps. Y no es barato.
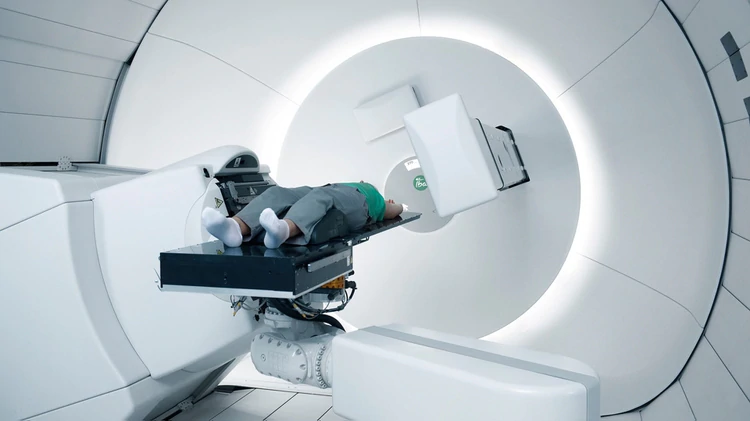
Uno de los radioquirófanos de un centro de protonterapia en EEUU, con sus cabezales rotativos esterotácticos… y su costo de U$ 220 millones (en 2014)
En contraste, un acelerador de neutrones como el de Kreiner para BNCT difícilmente supere ¿diez millones de dólares, con búnker incluido? Eso, o menos, por su sencillez de diseño, y el hecho de que la iluminación de los tumores no es “esterotáctica”. Si se usan neutrones y se dopan los tumores con boro, no hay modo de torcer, dirigir o enfocar los haces de partículas, ni hace falta hacerlo.
Con este aparato y desde 2016, el país tuvo una oportunidad REAL de hacer estudios clínicos de fase 1, 2 y 3 con un aparato de ingeniería y costos sensatos. Era el momento de convencer a los radio-oncólogos no creyentes en el neutrón, o a los simplemente desilusionados, de que no han esperado 30 años en vano. Pero eso no sucedió.
Bajo la dirección de los caciques petroleros del ciclo macrista, señoras y señores, la CNEA perdió el 53% de su presupuesto en 4 años. En 2015, fue de U$ 363 millones, y en 2019, de U$ 170. Se paró casi todo proyecto de investigación, se atrasaron y luego frenaron obras críticas como las del reactor RA-10 de Ezeiza y el CAREM 25 en Lima, éste con 500 suspensiones, se cerró la Planta Industrial de Agua Pesada (PIAP) en Neuquén con el raje de más de 400 profesionales y técnicos especializados, y la lista de daños sigue y sigue. De tener la mayor fábrica de agua pesada del mundo pasamos a ser importadores, para que no se apaguen las Atuchas I y II y Embalse.
En cuatro años retrocedimos veinte.
En la debacle general, el equipo de Kreiner sobrevivió al “presupuesto cero” que decapitó a muchos otros sólo porque estaba defendido por contratos de construcción y equipamiento firmados antes de 2016. Su caída habría generado juicios contra la CNEA.
Julián Gadano, Subsecretario de Energía Nuclear (cargo creado ad-hoc) y presidente de hecho de la CNEA, no se puede ver con Kreiner… y viceversa. Kreiner no puede perdonarle a Gadano el cierre de la PIAP o la cancelación de la central CANDÚ “Proyecto Nacional”, y Gadano no pudo echar a Kreiner porque además de una foja intachable como físico nuclear, es un jefe sindical de APCNEAN, la asociación de profesionales de la CNEA. Opositor duro y puro a su administración, y desde el día cero.
De modo que Gadano sostuvo el proyecto BNCT como la cuerda al ahorcado. La empresa constructora a cargo debió haber terminado en 2017 un búnker donde cupiera una máquina del doble de voltaje que la que se ve en la foto, pero esa firma adoptó la costumbre de detener la obra para renegociar, generalizada hoy entre todos los contratistas de la CNEA, razón por la cual el Programa Nuclear sigue en cierta catatonia.
Desde 2016 el proyecto siguió vivo sólo por la vocación de Kreiner de remar en dulce de leche y hacerlo avanzar contra la mala leche y el destrato institucional. En diciembre de 2018 hubo un congreso de BNCT en Taipei, capital de Taiwan, en el cual había 8 países interesados por la presentación argentina, y 3 posibles clientes. Gadano se negó a pagar la asistencia de Kreiner. Para papelón nacional, la plata la puso toda el gobierno de Taiwan.
En los congresos de radioterapia suele haber más acción en los pasillos que en las ponencias. Ahí fue que el KIRAMS coreano se acercó a Kreiner con ánimo de comprar la tecnología y un cheque no muy jugoso (U$ 700.000).
En la breve negociación, el físico argentino defendió 2 cosas: la propiedad intelectual del desarrollo, y que la plata se depositara en la Fundación Balseiro, de la CNEA, para su empleo en hacer avanzar esta terapia, en lugar de disolverse al cuete en la contabilidad general de la nación. Es lo que permite desde hace años la ley de venta de tecnología argentina.

Foto oficial del congreso de BNCT en 2018 celebrado en Taipei donde se vendió la transferencia de tecnología del acelerador criollo de neutrones al KIRAMS coreano. Andrés Kreiner es el tercero desde la izquierda en la segunda línea.
Gadano se fue (por ahora), pero episodios y personajes como éste seguirán ocurriendo mientras la CNEA, que se ocupa más de asuntos estratégicos que de prender la luz, no vuelva a depender de la Presidencia de la Nación, como manda la lógica de estado. Y se independice así de los lejanos caciques petroleros, la fauna habitual de la Secretaría de Energía. Según usos y costumbres, los mandamases del Oil & Gas no son gente que vaya a poner un mango en desarrollos radioterapéuticos criollos.
Si les hablan de energía atómica, los tipos recuerdan que 1000 megavatios nucleoeléctricos nuevos son 1.600 millones de metros cúbicos anuales de gas natural que no te van a poder vender. Y si se agarran un cáncer jodido, se van a hacer tratar en EEUU. Seguramente en algún sitio de decoración cálida con piedra, madera y teja.
La dirección nuclear puesta por el macrismo perduró insólitamente hasta este invierno, si eso sirve como indicador del entendimiento o el entusiasmo del gobierno actual por la tecnología atómica local. Hace pocos meses que tenemos autoridades nucleares nuevas, y sin discusión, mejores. Mucho mejores.
Para desconcierto de japoneses y estadounidenses, Kreiner se les coló por un lateral, a lo Messi, y logró vender la tecnología argentina para BNCT en Corea porque es más sensata, punto.
Pero no es profeta en su tierra. Y aquí el búnker para su acelerador sigue sin construir.
Daniel E. Arias


