
Hablemos de remdesivir, porque parece la primera cosa con alguna efectividad real contra el Covid-19. Tal vez no sea la última.
Quizás estamos “en un momento Fauci”, como en 1987, cuando el infectólogo Anthony Fauci, jefe del National Institute for Allergy and Infectious Diseases (NIAID) de los EEUU, hizo oficial que el AZT frenaba bastante la replicación del virus HIV, causante del sida. Desde entonces, transcurrió mucha química y como 6 presidentes, el sida pasó de condena de muerte a ser otra enfermedad crónica manejable y Fauci sigue en su puesto.
El NIAID forma parte del National Institute of Health (NIH), el equivalente de un ministerio de salud pública en un país que prácticamente carece de ella. Por prestigio, Fauci es el único alto funcionario del gobierno de Donald Trump capaz de llevarle públicamente la contra y sobrevivir. Con esta fúnebre novedad del virus SARS-CoV-2 lo desmintió ante cámara varias veces. Por ende, el mundo entero paró la oreja ayer cuando Fauci anunció que el remdesivir acelera un poco la recuperación de los enfermos de Covid-19 que necesitan de hospitalización.
Se espera que la FDA, el organismo de licenciamiento farmacológico de los EEUU oficialice la noticia. Fauci fue mucho más cauteloso que en 1987, cuando presentó el AZT, cuyos efectos eran más taxativos. Con el remdesivir, Fauci dijo que este antiviral es más bien un “proof of concept”, una demostración conceptual de cómo entrarle al virus atacando una de sus enzimas, la “polimerasa ARN-dependiente del ARN” (no es una mala traducción, juro que se llama así). Ese engendro lingüístico es una maquinita química que le sirve al virus para ir uniendo nucleótidos cuando copia su cadena de genes, en su negocio de hacer miles de réplicas de sí mismo.
¿Da para sacar el champagne? Mejor dejarlo que se siga enfriando. En el primer ensayo clínico a doble ciego hecho en EEUU, que empezó con sólo 13 pacientes pero al que se sumaron los de 68 hospitales yanquis y 21 europeos y asiáticos, el remdesivir acortó el tiempo de recuperación de 15 a 11 días. Este “trial” gigantesco de un millar de pacientes lo inició y dirigió el Dr. André Khalil, de la Universidad de Nebraska, quien por su actuación anterior con virus zoonóticos emergentes (Ebola, SARS, MERS) tiene acceso directo a un bloque de 10 grandes hospitales estadounidenses llamado “UNMC Biocontainment Unit”. El bloque está preparado para gestionar incendios pandémicos inesperados, como el actual.
Con un testeo multicéntrico masivo, el del remdesivir es un efecto clínico claro, medible estadísticamente, indiscutible pero modesto. Nadie puede decir a ciencia cierta que el remdesivir haya salvado a nadie, pero lo puede sospechar. También ilustra para qué lado volarán los tiros ahora: seguramente se lo testeará contra otros antivirales, pero también en combinación con ellos.
Si sirve como modelo histórico de lo que podría suceder, el AZT viene de 1964. Se desarrolló inicialmente para combatir cánceres disparados por retrovirus en aves, y luego en el sarcoma de Harvey o el de Friend, también mediados por virus. Pero en 1985 mostró una eficacia clínica contundente contra el HIV y en 1987 se lo licenció como monoterapia. Inmediatamente tuvo que acompañárselo de otros anti-retrovirales para preservarlo, porque el virus de cada paciente se volvía resistente a gran velocidad cuando el AZT era empleado en solitario. Esto provocaba casos iniciales de retroceso de la enfermedad, pero ningún alargamiento de la esperanza de vida.
Desde 1995 cualquier terapia estándar contra el sida usa no menos de 5 moléculas dirigidas contra 5 procesos mediados por 4 enzimas virales del HIV. De la monoterapia se pasó a los cócteles. Si bien no hay modo de extirpar los genes virales del ADN del infectado, lo que se logra es que éste no contagie la enfermedad y logre alcanzar su expectativa normal de vida.
El costo de los cócteles, por supuesto, es ruinoso para casi cualquier individuo, y sólo se vuelve accesible cuando de las compras y el suministro se encarga el estado.
Como sucedió con el AZT, el remdesivir también se desarrolló y testeó en humanos contra otro blanco, el virus del Ebola, durante el brutal brote de 2014 y 2015 en África Occidental. Antes había funcionado bien en modelos animales (monos rhesus, mayormente) con dos respiratorias regionales muy letales pero menos infectivas, ambas a coronavirus, el SARS y el MERS.
Aunque el remdesivir formalmente no terminó su testeo en fase III y no está licenciado por la FDA, eso está por cambiar muy rápido, y las acciones de Gilead están subiendo como un misil antiaéreo.
La historia sirve como recordatorio de que ante las virosis emergentes, las farmacológicas prefieren usar primero su arsenal viejo: podrá haber sido inefectivo contra el virus tal, podría ser mejor contra el virus cual, pero lo fundamental es que ya se conocen los efectos adversos.
Por lo demás, en la lucha contra virus a ARN se usan “nucleótidos truchos”: en eso el AZT y el remdesivir se parecen. Al copiarse a sí mismo, el virus echa mano de los nucleótidos “legítimos” que encuentra dentro de la célula para ir armando una cadena lineal, un polímero que codifica la información para construir nuevos virus. La molécula de AZT o la de remdesivir sustituyen a dos nucleótidos verdaderos, y logran que el copiado de la cadena se interrumpa ahí. Es un truco efectivo, pero los virus a ARN mutan rápido y logran evadir este tipo de trampas dirigidos contra una única enzima de copiado. Lo que sirve es acorralar al virus, atacar tres o cuatro enzimas de copiado con varias moléculas, pero en el caso del SARS-CoV-2 tenemos sólo un arma inicial. Hasta ayer, no teníamos nada.
El Dr. Pedro Politi, un oncólogo y farmacólogo relevante, me viene diciendo desde fines de febrero que el remdesivir iba a ser lo primero efectivo, aunque no necesariamente lo más efectivo. Habiendo hecho parte de su carrera en el National Cancer Institute de Bethesda, Maryland, lee regularmente lo que está “in the pipeline”, es decir atravesando ensayos clínicos de fase monitoreados por la FDA. Es información pública, pero no todo el mundo médico la lee. Sí lo hacen los fondos de inversión.
¿Cuáles son los efectos colaterales de este antiviral? “Los imaginables serían anemia y leucopenia (disminución de glóbulos blancos) –dice Politi- Puede haber daño renal, porque el remdesivir es un nucleótido con fosfato que usa el mismo sistema de excreción de otros ácidos orgánicos, como la aspirina: a través de los túbulos renales. Y puede haber otras toxicidades… es temprano para saber.
“¿Un ‘tip’?- se pregunta Politi- El remdesivir se parece químicamente al tenofovir, que se usa contra el HIV. ¿Una evaluación? 11 versus 15 días… Es cierto, mejor irse a casa.
“¿Eso es todo? No –sigue Politi- Desde el punto de vista de la salud pública, son 4 días ganados para que haya camas de intensiva para los pacientes agudos cardíacos. Estos fueron olvidados, como acaban de denunciar en el New England Journal of Medicine un grupo de 6 cardiólogos del hospital universitario de Turín, Italia. De modo que el remdesivir ayuda. Pero no es ‘la bala mágica’. No es un ‘home run’”.
¿Y CÓMO VENIMOS DE VACUNAS?
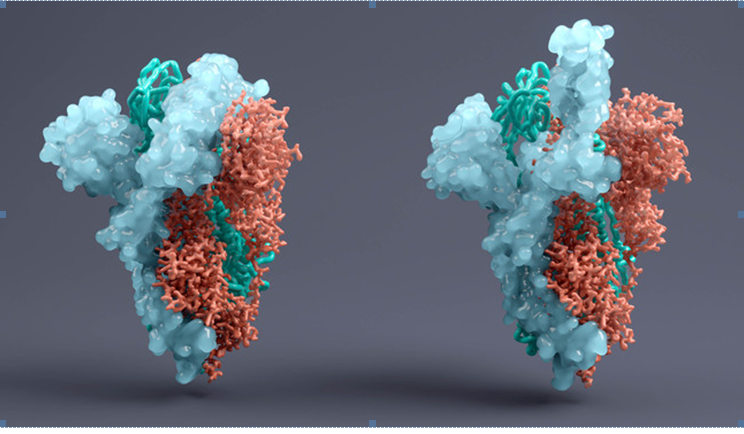
Modelos del “antígeno Spike” con que el virus SARS-CoV-2 se pega a las proteínas ACE-2 de superficie de los tejidos respiratorios, renales, intestinales y cerebrales. Instituto Paul Ehrlich.
Reina un exitismo infundado con el tema vacunas. Un ensayo británico a doble ciego liderado por la Universidad de Oxford acaba de inyectar al primer paciente de un grupo de 1100 voluntarios sanos adultos, la mitad de los cuales recibirá un placebo sin saberlo. Luego se comparará la performance clínica de las dos cohortes, con la esperanza de que quienes recibieron realmente la vacuna estén más blindados ante el SARS CoV-2.
Podría haber resultados preliminares en agosto. Pero de aquí a que haya una vacuna licenciada y lista para uso masivo en un año, o un año y medio, como se dice, es irreal. Lo que vale para la de Oxford vale para otras de las más de 100 formulas que compiten por llegar primero al licenciamiento, que de suyo es un hito difícil. Pero si se le suma el doble cuello de botella que significan la producción masiva y la logística, empieza a entenderse por qué el tiempo promedio de desarrollo de una vacuna supera los 10 años y 8 meses.
La excepción reciente fue la vacuna contra el Ebola, que desde su formulación hasta su despliegue tomó 5 años. Lo que aceleró todo con el Ebola fue su llegada masiva a las ciudades-puerto atlánticas de África Subsahariana en 2015: desde allí, el salto inminente a Europa, Asia y las Américas era cantado. Eso abrió muchos bolsillos normalmente cerrados.
En promedio, de todas las fórmulas de vacuna consideradas para todas las enfermedades, según la revista británica New Scientist, sólo el 6% llega a pruebas de fase I, II y III, y las que cruzan estas tres barreras aún tienen una chance de licenciamiento y despliegue del 33,4%, asunto en el que pesa mucho el apoyo financiero.
Puede decirse que todo esto era verdad antes de la pandemia, y que ahora la presión por salir de la cuarentena obligará al mundillo del licenciamiento farmacológico a mover las tabas como jamás antes. El asunto es cuántos recaudos de seguridad pueden perderse en los estudios de fase.
En el caso de la vacuna de Oxford, Matt Hancock, el Ministro de Salud del gobierno de Boris Johnson, dijo que el estado británico pondrá la plata que haga falta para llegar a su producción masiva, o la de la fórmula del Imperial College de Londres. Y estamos hablando de proyectos que recién inician una fase 1. Bill Gates, en plan filántropo desde hace tiempo, dice que apoyará simultáneamente 7 vacunas, una estrategia que (asegura Gates) le hará perder plata pero ganar tiempo. Por supuesto, nadie cree que Gates sepa siquiera cómo perder plata.
El asunto es que tirarle eso mismo, plata, al virus SARS CoV-2 tal vez no alcance para matarlo. Los virus corona que más conocemos son los 4 del resfrío, y no dejan mayor huella antigénica. Quien se resfrió y se curó no tiene anticuerpos suficientemente durables como para no resfriarse de nuevo, y con la misma especie, 3 meses después. La reinfección parece norma con los únicos 4 corona que tenemos bien estudiados. ¿Y si el SARS CoV-2 se pareciera a esos parientes?
Hay demasiado de este bicho nuevo que ignoramos. Como virus a ARN hasta el momento ha sido relativamente estable en su genoma, pese a haberse desparramado por todos los continentes menos la Antártida. Pero lo característico de los virus a ARN, que carecen de sistemas de corrección de error en el copiado genómico, es la mutación constante.
Eso es lo que hace que cada año debamos cambiar de vacuna antigripal. De un año a otro, el genoma del virus viral prevalente ha cambiado y la vacuna que servía antes ahora protege menos, y la actualizada da una cobertura parcial, porque en el curso de la temporada fría el virus sigue mutando. Estamos resignados a ello.
Por ahora, tiene vigencia la observación de Mark Woolhouse, epidemiólogo de la Universidad de Edinburgo, citada por New Scientist: “No me parece que haya que glorificar con la palabra ‘estrategia’ eso de esperar una vacuna. No es una estrategia: es una esperanza”.
La salida de cuarentena del mundo está sucediendo a la brava, sin “balas mágicas” antivirales y sin vacunas efectivas y seguras. A todo eso le falta demasiada cocina. Habrá que arreglarse un tiempo como los coreanos o los chinos: testeo intensivo con mejores tecnologías que las de hoy, rastreo de contactos toda vez que alguien da positivo para poner en cuarentena a los posibles infectados, y nuevos cierres de la economía, pero geográficamente acotados a los sitios de reinfección.
Durante unos años, no habrá tiempo para aburrirse.
Daniel E. Arias

