-
Una vacuna argentina contra el covid es una meta sobre la que hemos publicado -y combatido por- mucho en AgendAR.
-
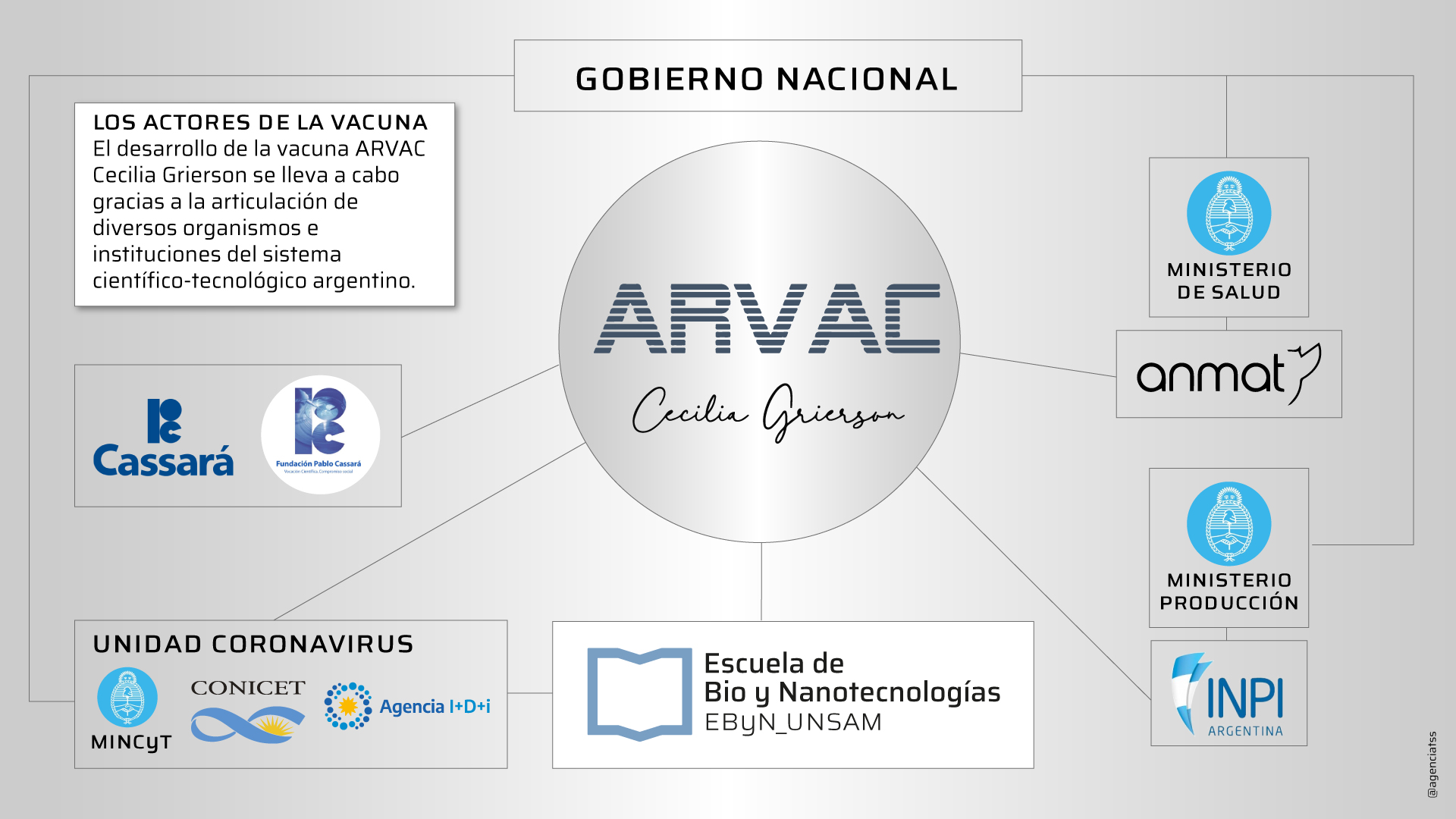
Aquí la periodista Vanina Lombardi resume su gestación, fruto de una articulación público-privada entre la UNSAM, el CONICET y el Laboratorio Cassará.
-
Ahora, tras haberse aprobado el inicio de las pruebas de seguridad en humanos está más cerca de convertirse en una plataforma local para la fabricación de vacunas frente al COVID-19. ¿Cuáles son los aprendizajes y desafíos de este proyecto para el sistema científico y tecnológico argentino?
Durante todo el año pasado, cada vez que a Juliana Cassataro le preguntaban si había alguna novedad sobre el desarrollo de la vacuna contra COVID-19, casi siempre respondía lo mismo: “Estamos trabajando en poner a punto la tecnología para empezar los ensayos clínicos”. Es que ese puente que va desde un ensayo de laboratorio con frasquitos y ratones hasta un prototipo escalable industrialmente que pueda utilizarse en humanos se siente más bien como dar un salto al vacío.
Pero la irrupción de la pandemia vino a revolucionar las formas de hacer ciencia. Como cuando en 2020 científicos de todo el país dejaron de lado sus líneas de investigación para dedicarse a producir herramientas que permitieran enfrentar y reducir los efectos de la COVID en la sociedad. Por eso, para dar el salto a la fase clínica, el equipo de investigadores de la UNSAM dirigido por Cassataro trabajó con una empresa de capitales nacionales con trayectoria en producción pero también en investigación: el Laboratorio Cassará.
Así fue como, el 30 de marzo, finalmente, llegó el anuncio esperado. Luego de evaluar todas las partes del proceso de producción, la ANMAT, organismo regulatorio nacional, autorizó que la vacuna desarrollada entre la UNSAM, el CONICET y el Laboratorio Cassará comenzara la Fase I de la etapa clínica de investigación. Es la primera vez que una vacuna preventiva diseñada en una universidad argentina llegó a la etapa de pruebas en humanos.
“Desde el principio, apuntamos a desarrollar una tecnología que se pudiera hacer en la Argentina, con la capacidad que tenemos. Fue un desarrollo conjunto con el laboratorio porque a partir de que empezamos a trabajar juntos todo se aceleró y se comenzó a pensar en función de la capacidad de desarrollo y de producción que ellos tienen”, cuenta Cassataro, doctora en Ciencias Biológicas, investigadora del CONICET en la Escuela de Bio y Nanotecnologías de la UNSAM, y responsable del proyecto.
La tecnología elegida para desarrollar la vacuna, bautizada como ARVAC Cecilia Grierson en honor a la primera médica argentina, es la de proteínas recombinantes. Consiste en producir y purificar una proteína que forma parte del virus SARS-CoV-2 a partir de su cultivo en células. Una vez introducida en el organismo, esa proteína actuará como antígeno contra el cual el sistema inmunológico de las personas desarrollará anticuerpos. Se trata de una tecnología considerada segura y robusta que se usa, por ejemplo, en las vacunas para Hepatitis B (aplicada en recién nacidos) y HPV (en adolescentes).
La pregunta inevitable, que surgió en el equipo de Cassataro desde el primer momento, fue: ¿Vale la pena desarrollar una vacuna en el país cuando hay potencias que podían hacerlo más rápido? Lorena Coria, doctora en Ciencias Biológicas e integrante del equipo de la UNSAM, cuenta: “Es algo que nos lo preguntábamos a cada paso que íbamos dando y la respuesta siempre fue ‘sí’. Es un hito haber transitado este camino en tan poco tiempo y poder comenzar hoy los ensayos clínicos de una vacuna 100% argentina. Empezamos a hacerlo convencidas de que queríamos que llegue a ser algo que no quede solo en un paper, sino algo que pueda resolver una necesidad concreta de la sociedad”.
Carrera contrarreloj
La idea de hacer una vacuna contra COVID-19 surgió apenas empezó la pandemia. El Ministerio de Ciencia, Tecnología e Innovación (MINCYT), el CONICET y la Agencia Nacional de Promoción de la Investigación, el Desarrollo Tecnológico y la Innovación (Agencia I+D+i) conformaron la Unidad Coronavirus y abrieron la convocatoria a proyectos de investigación vinculados a la temática. El equipo de Juliana Cassataro venía trabajando desde hace años en el desarrollo de vacunas, más específicamente en uno de sus componentes: los adyuvantes, que tienen la función de potenciar la respuesta inmune en el organismo.
Al principio, tratar de hacer una vacuna desde cero en poco tiempo les pareció un horizonte muy lejano, así que plantearon algo un poco menos ambicioso: desarrollar métodos para estudiar la respuesta inmune y probar diferentes fórmulas en el laboratorio. Ganaron un subsidio y comenzaron con los ensayos, al mismo tiempo que otras universidades e institutos de la Argentina hacían lo propio, como la Universidad Nacional de la Plata y el Instituto Leloir. “A los pocos meses, cuando empezamos a tener resultados más prometedores, empezó a estar más clara la posibilidad de la vacuna y así que comenzamos a buscar una empresa”, cuenta la doctora Karina Pasquevich, también integrante del equipo de la UNSAM.

Pasquevich trabaja con Cassataro desde 2003, cuando comenzó a hacer su tesis doctoral sobre vacunas contra la brucelosis bajo su dirección. Lorena Coria, por su parte, ingresó al equipo en 2007, para realizar su tesis de grado. En ese momento, Cassataro trabajaba en el Hospital de Clínicas. A fines del 2013, todo el equipo se mudó a la UNSAM. Para Cassataro, la formación de recursos humanos es algo que realiza con orgullo. “Cuando veo trabajar a Karina y a Lorena lo siento como un logro. Es mérito de ellas igual, tienen una formación y una capacidad que me superan ampliamente”, señala.
El equipo de la vacuna fue fluctuando en cantidad de integrantes pero, en general, siempre fueron entre 8 y 12. Aparte del conocimiento de las inmunólogas, fue crucial el aporte de Diego Álvarez, director del Laboratorio de Virología Molecular del IIB-UNSAM, quien puso a disposición años de investigación en diversos tipos de virus, como los causantes de dengue y chikungunya.
Los primeros días de trabajo en el proyecto de vacuna no fueron fáciles porque eran meses aislamiento estricto. Intentaron resolver cosas por zoom pero enseguida se dieron cuenta que la mejor solución para avanzar rápido era que todos los integrantes fueran a trabajar de forma presencial. Varias de ellas tenían hijos en edad escolar, lo cual complicó la logística. Pero pudieron acomodarse y, en pocos meses, obtuvieron los resultados preclínicos necesarios para empezar a pensar en las pruebas en humanos.
“Para mí, la presión de tener que hacer algo a contrarreloj fue una gran motivación. Creo que al principio muchos no confiaban en que era viable hacer esta vacuna. Nosotras quizás tuvimos dudas en cuanto al tiempo que nos podía llevar pero siempre creímos en nuestras capacidades. Y el pasaje del laboratorio a producir en una planta fue un gran aprendizaje. Formamos un buen equipo con Cassará”, dice Coria.
La unión hace la vacuna
Tras reunirse con varios laboratorios con capacidad para producir proteínas recombinantes –encuentros en los que la Agencia I+D+i ofrecía su acompañamiento–, a finales de 2020 las conversaciones con el Laboratorio Cassará ya estaban avanzadas para trabajar en conjunto. “Que la empresa tuviese un área de I+D fue fundamental, tenían investigadores como nosotros. A partir de eso aceleramos mucho porque hablábamos el mismo idioma”, dice Cassataro.

Cassará es una empresa familiar con más de 50 años de historia nacida en el ámbito farmacéutico y que hace un par de décadas ingresó en el campo de la biotecnología con una fuerte inversión en investigación y desarrollo, al punto que actualmente tiene más de 20 investigadores abocados al proyecto de la vacuna.
El laboratorio le sumaba al proyecto capacidades que el grupo de Cassataro no tenía en el ámbito de investigación universitario, como las buenas prácticas de manufactura (GMP, por su siglas en inglés), un estándar indispensable en el desarrollo farmacéutico para poder obtener la aprobación regulatoria que permita realizar pruebas clínicas.
“Hay ensayos que te pide ANMAT que vos tenés que presentar con la fórmula producida ya en la planta, con GMP, con lotes controlados, análisis toxicológicos, todo validado, cosas que nosotros no podíamos hacer”, explica la responsable del desarrollo de la ARVAC Cecilia Grierson.
El desarrollo de una vacuna en medio de una pandemia exigía decisiones sobre qué caminos tomar, en algunos casos por la necesidad de avanzar lo más rápido posible; en otros por las restricciones propias del sistema científico-tecnológico local y hasta por posibles trabas que podían surgir en aspectos de propiedad intelectual.
En la elección de uno de los tres prototipos de vacuna que tenían también influyeron las tecnologías disponibles y la evolución de la situación epidemiológica local. Así fue como definieron ir con el de respuesta intermedia para la vacuna de refuerzo y cambio de variante, dado el alto porcentaje de población ya vacunada en la Argentina, y dejar para más adelante uno con un nuevo adyuvante –el componente de la vacuna que activa el sistema inmune–, que daba una respuesta más potente pero que podía retrasar el desarrollo de una vacuna de refuerzo. Otro, que utiliza un baculovirus, fue descartado por la falta de capacidades locales en desarrollo a escala industrial para este tipo de compuestos.
Cassará tenía experiencia en la producción de proteínas recombinantes, la estrategia elegida por el equipo de Cassataro. “Nosotros teníamos una plataforma para generar un sustrato celular que es un clon, una célula CHO (siglas de ovario de hámster chino, cuyo uso está ampliamente extendido en el campo de la biotecnología), en la que venimos trabajando desde el año 2009 y con la que hemos logrado una buena productividad, conocemos bien el medio de cultivo y la forma de introducir el material genético en la célula”, explica Juan Manuel Rodríguez, coordinador del Laboratorio de I+D y Biofármacos del Laboratorio y la Fundación Cassará.
Según Rodríguez, cada decisión que tomaban en conjunto con el grupo de investigación de la UNSAM era un riesgo, pero en general estaban orientadas a que el camino fuera lo más simple posible. “Decidimos usar muchas herramientas que ya teníamos, como las resinas para purificar proteínas que veníamos usando. Para la formulación definitiva de la vacuna decidimos combinar el antígeno con un adyuvante conocido como el hidróxido de aluminio, y dejar relegado el que tenía la UNSAM y otro nuestro, que podían tener más trabas para su aprobación. Ambos grupos relegamos el ego personal para que todo saliera más rápido”, dice.
Con esa fórmula se hizo el primer lote, en agosto de 2021, y un mes después se produjo el lote preclínico –la versión que se aplicó en animales– que ya no se volvió a modificar. Según los resultados de esa instancia, finalizada en diciembre de 2021 y cuyos resultados fueron presentados a la ANMAT, la ARVAC Cecilia Grierson induce anticuerpos neutralizantes contra las variantes del virus SARS-CoV-2 que circulan en la Argentina, así como respuesta celular T (la otra reacción inmunológica frente al virus).
Cambio de fase
En los estudios de Fase 1, que comenzaron tras su aprobación el 23 de marzo pasado y que se realizan sobre una población de 80 voluntarios en la Ciudad Autónoma de Buenos Aires, se pone a prueba la inmunogenicidad de la vacuna, es decir, la capacidad que tiene la vacuna para activar el sistema inmunitario e inducir una respuesta del organismo. “Como están vacunados casi no se puede medir eficacia, entonces la mayoría de los estudios está buscando medir anticuerpos neutralizantes contra las variantes del virus que están circulando. Lo que vamos a ver es cuánto aumenta la respuesta inmune luego de la dosis de refuerzo”, explica Cassataro.
Si bien los plazos previstos para la Fase 1 son de alrededor de tres meses para disponer de los primeros resultados, en total se hará un seguimiento de los voluntarios durante 12 meses. Esta fase está financiada por el Laboratorio Cassará, con una inversión de alrededor de 450.000 dólares. Hasta entonces, el proyecto había tenido una inversión inicial por parte del Estado de 7.200.000 pesos, que después tuvo un refuerzo de 60 millones.
Hacia mitad de la Fase 1 se espera poder generar un reporte interno que ya permita ir avanzando en la preparación de las Fases 2 y 3, que presentan mayores desafíos desde la logística, al implicar varios centros y alrededor de 4000 voluntarios, que permiten tener un relevamiento estadístico más sólido sobre las condiciones de seguridad e inmunogenicidad. La inversión también es de otra escala: a precios internacionales que oscilan entre los 6000 y los 7000 dólares por persona, la inversión necesaria no bajaría de los 24 millones de dólares.
“Para el financiamiento de la Fase 2/3 –que también demandaría alrededor de tres meses y un seguimiento por un año– estamos explorando distintas alternativas. Una es un financiamiento del Ministerio de Desarrollo Productivo, que se mostró interesado. Como es una plataforma conocida y segura no esperamos que haya problemas de seguridad. Es, más que nada, ver la eficacia en levantar anticuerpos como vacuna de refuerzo”, dice Jorge Cassará, presidente del Laboratorio Cassará.
De atravesar con éxito estas fases, la ARVAC Cecilia Grierson, que es un desarrollo conjunto entre el CONICET, la UNSAM y la Fundación Pablo Cassará, podría comenzar a ser fabricada para su comercialización. “Podría haber alguna sub-licencia a otras empresas pero nosotros tenemos una capacidad de producción para hacer 40 millones de dosis por año. Si la demanda fuera mayor, ya tenemos identificadas algunas empresas donde se puede ampliar la capacidad sin necesidad de hacer una planta nueva”, dice Cassará con respecto a las eventuales capacidades de producción de una vacuna.
El valor de la vacuna propia
Si la ARVAC Cecilia Grierson atraviesa de manera exitosa todas las fases de investigación y es finalmente aprobada por la ANMAT, podría empezar a fabricarse a finales de este año. En el Laboratorio Cassará aseguran que también podría exportarse y que han conversado con algunos países que están interesados.
“Que la Argentina cuente con un proyecto como el de ARVAC no es solo una cuestión estratégica, sino que permite encauzar ciertas inversiones del Estado en el sector de I+D y las pone en diálogo y asociación con el sector productivo local, como es el caso de la industria farmacéutica local, que siempre fue muy buena pero sobre todo como envasadora y distribuidora de principios activos desarrollados en otras partes. En cambio, en este proyecto se puede cerrar todo el circuito, desde lo que es la I+D hasta el escalado productivo con normas GMP, y todo eso traccionado con la compra de vacunas por parte del Estado”, dice Diego Comerci, doctor en biología molecular y biotecnología, investigador del CONICET y subsecretario de Desarrollo e Innovación de la UNSAM.
Según Comerci, “venimos viendo al Estado como promotor, financiando proyectos e infraestructura en I+D, dando créditos y potenciando el sector empresarial local. También en su función reguladora, con la ANMAT, pero también necesitamos el rol del Estado generando demanda, sobre todo de los proyectos en los que invirtió. De lo contrario, se dejaría esto librado a la suerte en un mercado farmacéutico hiperconcentrado a nivel global, con cinco grandes jugadores”.
Una de las ventajas de la tecnología de proteína recombinante es su flexibilidad, ya que permitiría adecuar la vacuna contra nuevas variantes que circulen en el futuro. “La idea es que esta plataforma sea el inicio, que se pueda usar para otras vacunas y que no tengamos que estar gastando divisas para importarlas”, dice Coria, quien junto con Pasquevich son las investigadoras más cercanas a Cassataro. “Me gustaría llegar al final, tener una vacuna y después seguir trabajando en adyuvantes para vacunas orales –una de las principales líneas de investigación del grupo–, eso sería como un sueño cumplido”, agrega Pasquevich.
Rodríguez, desde el Laboratorio Cassará, destaca la necesidad de que haya más grupos de investigación en las empresas y que la vinculación del sector privado con los grupos que hacen ciencia en universidades no sea algo mal visto. “Más allá del camino que recorrimos, lo más importante es que este proyecto de vacuna llegue a la sociedad, eso es lo que le va a terminar de dar sentido”, dice.
Cassataro rescata también los aprendizajes que acumularon en un ritmo de trabajo que fue más vertiginoso que lo habitual. “Si bien siempre trabajamos sobre cosas que tenían una aplicación, nuestra cabeza cambió con este proyecto, en el sentido de que aprendimos mucho sobre cuestiones regulatorias, sobre cómo pensar lo que hacemos en términos de producción, de cómo hacer las cosas más rápido, reutilizar procesos y no partir de cero cada vez”.
También tuvieron que lidiar con la incertidumbre que desató la COVID en todos los ámbitos, en el que la ciencia no fue la excepción. “Pensábamos si tenía sentido lo que estábamos haciendo porque todo cambiaba muy rápido. Con los recursos que teníamos era imposible que llegáramos al mismo tiempo que grupos que vienen trabajando desde hace 30 años, que tenían sus plataformas ya probadas en humanos y que disponían de miles de millones de dólares para trabajar. Pero si nos quedábamos en eso, no hacíamos nada”.


